Immunofluorescenza e diagnostica neuropatica
🔬 L’immunofluorescenza è una metodica di laboratorio, adoperata sia in diagnostica che in ricerca. Scopriamola insieme!
Immunofluorescenza per lo studio dell'innervazione intraepidermica nella diagnosi di neuropatia delle piccole fibre
Introduzione
L’immunofluorescenza (IF) è una metodica di laboratorio, adoperata sia in diagnostica che in ricerca, che trova applicazioni in svariati ambiti (istologia, citologia, microbiologia, parassitologia) ed è compresa nelle tecniche ultrastrutturali, cioè che vanno oltre la semplice morfologia. Focalizzandoci nel campo dell’istologia (lo studio dei tessuti), l’IF permette di rilevare specifici componenti che risulterebbero impercettibili al classico esame istologico, in cui si osservano esclusivamente le caratteristiche morfologiche del campione. Questi componenti, comunemente denominati marcatori o antigeni, sono proteine o strutture molecolari complesse espresse dalle cellule del tessuto, per esempio filamenti intermedi, proteine strutturali, enzimi, ormoni, fattori di trascrizione. Il processo può essere paragonato all'osservazione di una foglia: ad occhio nudo scrutiamo le caratteristiche più grossolane (forma, colore, margine e nervature), mentre, se usiamo strumenti ad alto ingrandimento, come un microscopio, possiamo scorgere ulteriori proprietà invisibili ad occhio nudo (cellule, stomi e fibre).
In questo articolo illustreremo l’impiego dell’IF su biopsia di cute allo scopo di diagnosticare le neuropatie delle piccole fibre, un sottotipo di neuropatie divenute oggetto di interesse in tempi relativamente recenti.
Le neuropatie periferiche sono un gruppo di malattie in cui è presente un danno e un malfunzionamento dei nervi periferici. Sono caratterizzate da sintomi e segni neurologici eterogenei, tra cui i più comuni sono riduzione o assenza dei riflessi osteo-tendinei, debolezza muscolare, deficit di sensibilità tattile, vibratoria, termo-dolorifica, deficit di propriocezione con perdita dell’equilibrio, parestesie a tipo formicolio e addormentamento, dolore neuropatico sotto forma di bruciore, sensazione di aghi e spilli, scosse elettriche, prurito.
Le neuropatie delle piccole fibre sono neuropatie caratterizzate da un interessamento selettivo delle fibre C amieliniche e delle fibre A-delta mieliniche di piccolo calibro, che non possono essere diagnosticate mediante il convenzionale studio di conduzione nervosa (elettroneurografia), dal momento che questo riflette soltanto la funzione delle fibre A-beta mieliniche di grande calibro. Si presentano principalmente con dolore neuropatico, verosimilmente legato a una disfunzione delle terminazioni nocicettive, deficit di sensibilità termo-dolorifica, e disturbi autonomici legati a una disfunzione delle fibre C autonomiche. Tra questi ultimi i più comuni sono l’intolleranza ortostatica, disturbi della sudorazione, dell’alvo e della minzione.
Le neuropatie periferiche, incluse le neuropatie delle piccole fibre, riconoscono molteplici eziologie, tra cui le principali sono metaboliche, come il diabete, carenziali (deficit di vitamina B1 e B12), autoimmuni (lupus eritematoso sistemico, sindrome di Sjögren), infettive (HIV, HCV, Borrelia burgdoferi), tossiche (alcool, mercurio, arsenico, piombo), iatrogene (chemioterapici), paraneoplastiche, legate a mutazioni genetiche.
L’epidermide ha un’innervazione costituita principalmente da fibre di piccolo calibro C e A-delta con funzione termo-nocicettiva, che trasmettono informazioni termiche e dolorifiche e che possono essere quantificate mediante l’analisi di campioni istologici di biopsia di cute.
La biopsia di cute costituisce uno strumento fondamentale nella diagnosi di neuropatia delle piccole fibre, che secondo i più accreditati criteri diagnostici si basa sul riscontro, in pazienti con sintomi compatibili (dolore neuropatico, disfunzione autonomica), di almeno due tra le seguenti alterazioni:
- Ridotta densità dell’innervazione intraepidermica, costituita da termo-nocicettori di piccolo calibro, alla biopsia di cute;
- Alterazione delle soglie termiche di percezione del caldo e/o freddo al Quantitative Sensory Testing (QST), un semplice test psicofisico in grado di valutare le principali soglie percettive relative alle diverse modalità sensoriali;
- Segni clinici di disfunzione delle piccole fibre (deficit di sensibilità termica e dolorifica).
Essendo la biopsia di cute una metodica mini-invasiva e facilmente ripetibile, la valutazione della densità delle fibre intraepidermiche può essere utilizzata anche per monitorare nel tempo i pazienti affetti da neuropatia delle piccole fibre.
L’immunofluorescenza
Facciamo una descrizione per capire esattamente cos’è l’IF e il principio su cui si basa. Innanzitutto, come accennato all'inizio, l’IF serve per evidenziare la presenza di antigeni espressi dal tessuto; per raggiungere tale scopo, questa tecnica ricorre ad anticorpi prodotti in laboratorio in due modi:
1) Si prende un modello animale (i più usati sono il topo e il coniglio,) gli si somministra una sostanza specifica contro la quale produce anticorpi (immunizzazione). In seguito si effettua il prelievo di un campione di sangue, da cui si ottiene il plasma o il siero, che viene purificato per ricavare gli anticorpi di interesse. Gli anticorpi prodotti in questo modo si definiscono policlonali, cioè riconoscono diverse parti di un singolo antigene;
2) Si immunizza un animale, se ne preleva la milza da cui estrarre i linfociti B (le cellule che generano gli anticorpi). Dato che i linfociti B muoiono nel giro di sette o dieci giorni, per evitare tale inconveniente, essi vengono fusi con cellule tumorali di mieloma, che sono immortali; la fusione delle due cellule forma l’ibridoma. Una volta creati, gli ibridomi si mettono in un terreno di coltura particolare, dipoi si esegue uno screening per selezionare il clone che sintetizza l’anticorpo di interesse. Gli anticorpi ottenuti con questa tecnica si chiamano anticorpi monoclonali, ovvero si legano ad un solo sito antigenico.
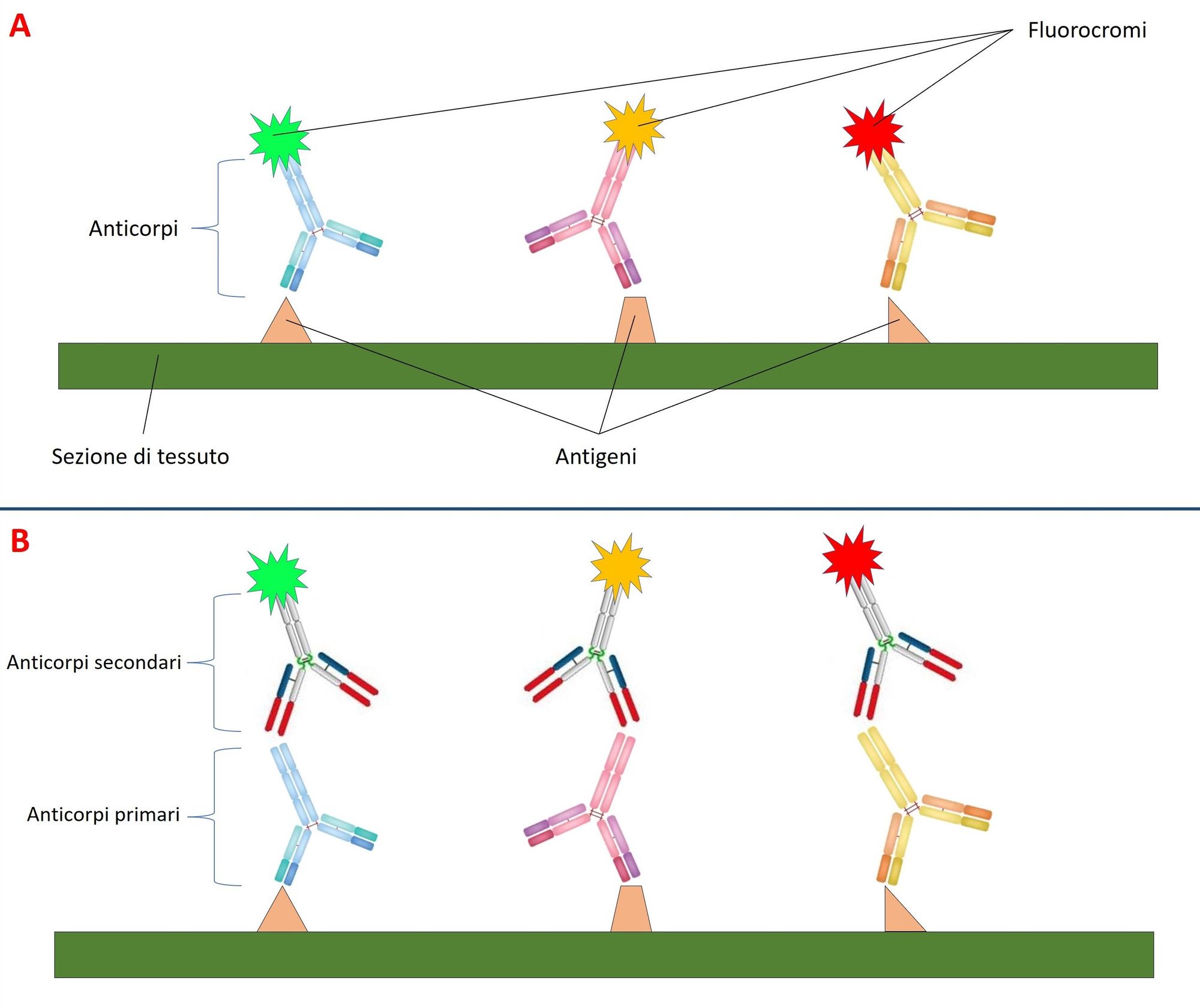
Affinché questi anticorpi permettano di marcare un antigene sulla sezione di tessuto, vengono coniugati con molecole fluorescenti (fluorocromi o fluorofori), che una volta eccitate da una radiazione elettromagnetica di una specifica lunghezza d’onda (raggi ultravioletti), la assorbono e la riemettono a una lunghezza d’onda maggiore (luce visibile). Nell’IF gli anticorpi applicati sul campione sono accoppiati con fluorocromi di diverso colore, e il preparato si osserva al microscopio a fluorescenza, ossia un microscopio in grado di emettere fasci di luce di diverse lunghezze d’onda. Le luci risultanti indicano la presenza e il punto in cui sono situati gli antigeni ricercati.
Ci sono due tipologie di IF, diretta e indiretta. Nella prima si impiega un solo anticorpo, marcato con un fluoroforo, che si lega all'antigene (Fig. 1A); nella seconda, invece, si applicano due anticorpi, un anticorpo primario non marcato, che si posiziona sull'antigene, e un anticorpo secondario che si lega al primario ed è coniugato con il fluorocromo (Fig. 1B). L’IF indiretta è quella che si adopera su biopsia di cute nella diagnosi delle neuropatie.
Analisi della biopsia cutanea
Fase preanalitica
Il prelievo del campione si effettua principalmente sulla gamba, a livello della caviglia e della coscia. La caviglia, rispetto alla coscia, raffigura la zona dove la biopsia si fa sempre, essendo il sito diagnostico e quello in genere interessato dai sintomi. La coscia si sceglie principalmente per vedere se la riduzione di fibre è lunghezza-dipendente o no. Se la riduzione è solo distale, si parla di “assonopatia distale”, e ciò vuol dire che la parte più distale dell’assone sta degenerando. Se sono ridotte sia la coscia che la caviglia, significa che la neuropatia non è lunghezza dipendente, e questo in genere succede nelle ganglionopatie, cioè le neuropatie con sofferenza del corpo cellulare del neurone sensitivo (in genere autoimmuni o paraneoplastiche).
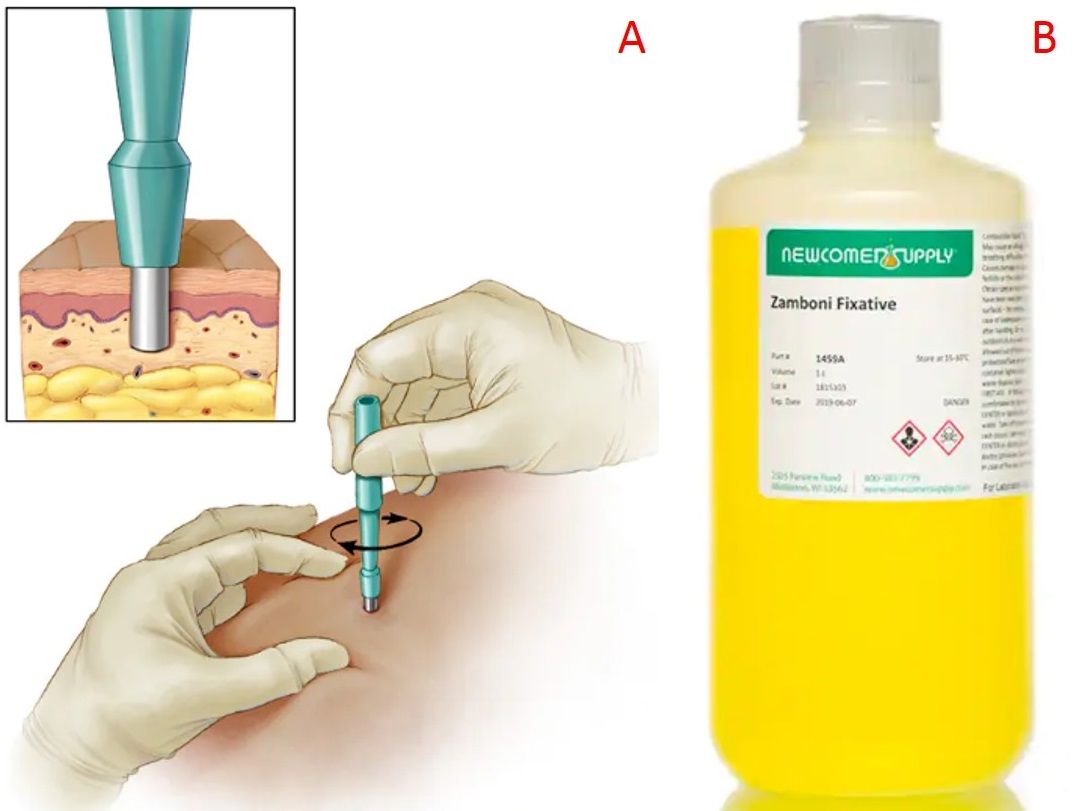
Prima del prelievo, la zona viene detersa, successivamente si fa un’anestesia locale con lidocaina mediante iniezione intradermica, e infine si preleva la biopsia. Quest’ultima procedura si esegue con il punch cutaneo, uno strumento a forma di penna dotato di una lama circolare con la circonferenza di 3 mm, che affonda nella cute prelevando epidermide, derma e ipoderma (Fig. 2A). Una volta che la lama è sprofondata completamente, si estrae facendo fuoriuscire la biopsia. Questa deve essere rapidamente posta in una soluzione liquida che ne impedisce la putrefazione e ne permette la conservazione, ossia un fissativo. Per l’esame istologico classico si usa la formalina; in questo campo, invece, si adopera la soluzione Zamboni (Fig. 2B), particolarmente adatta alla fissazione di tessuti altamente innervati, costituita da paraformaldeide, acido picrico e tampone fosfato. Poiché altamente tossica, è fondamentale manipolarla con i guanti. La biopsia deve restare nel fissativo per un minimo di sei ore fino a un massimo di ventiquattro. Terminata la fissazione, viene rimossa dal fissativo, immersa nel crioprotettore e tenuta in congelatore a -20° C fino al momento della processazione. Il crioprotettore è una soluzione semiliquida che protegge la biopsia dai danni da congelamento ed è composto da saccarosio, tampone fosfato, etilene glicole e polivinilpirrolidone (PVP).
Fase analitica
Questa fase inizia con l’inclusione della biopsia, che viene tolta dal crioprotettore, appoggiata su un oggetto di metallo a forma di fungo col cappello appiattito (Fig. 3A), ricoperta con un mezzo di inclusione (Killik, una sostanza collosa e trasparente che congela rapidamente a basse temperature) (Fig. 3C) e posta nel criostato-microtomo (Fig. 3D), un apparecchio specifico per il taglio delle biopsie, dove la temperatura è impostata tra i -20° C e i -26° C. All'interno del criostato, il mezzo di inclusione si solidifica e la biopsia rimane immobilizzata in un blocco (inclusione) (Fig. 3B). A questo punto si prosegue con il taglio: si incastra il blocco in un supporto collegato a una manovella esterna, si fissa la lama nel suo supporto, si sceglie lo spessore delle sezioni (in questo caso 50 µm) e si inizia a girare la manovella. La rotazione comporta un movimento dall'alto verso il basso e viceversa del campione, che si avvicina piano piano alla lama. Quando il campione e la lama si incontrano, quest’ultima rimuove il mezzo di inclusione in eccesso che copre la biopsia, permettendo quindi di farla emergere (Fig. 4A). Nel momento in cui si ottengono le sezioni, si prendono con una pinzetta o con un pennellino, e si collocano in una piastra da 96 pozzetti, ognuno di circa 5 mm di diametro (Fig. 4B). Questi sono riempiti con anticongelante, una soluzione semiliquida composta da glicerolo, tampone fosfato salino (PBS), etilene glicole e acqua distillata. L’anticongelante scioglie il Killik e impedisce il congelamento delle sezioni, permettendone quindi la conservazione a -20° C.
Nelle sezioni devono essere visibili le principali regioni della cute (epidermide e derma), per cui durante l’inclusione la biopsia deve stare in posizione trasversale.
Concluso il taglio, la piastra si pone su un agitatore fino al completo scioglimento del mezzo di inclusione, dopodiché si osserva allo stereomicroscopio (Fig. 4D), allo scopo di scegliere le sezioni su cui espletare l’IF. Le sezioni si prelevano mediante un’ansa di Billeau (Fig. 4C) e vengono trasferite nei pozzetti della prima fila di un’altra piastra, contenenti PBS. Quelli della seconda fila si riempiono con PBS-Tx (PBS con aggiunta di Triton X-100), che serve per permeabilizzare le membrane cellulari, affinché gli anticorpi possano entrare nelle cellule, mentre in quelli della terza si deposita il Block (PBS-Tx con 5% di siero di scimmia), che blocca i siti aspecifici dove gli anticorpi potrebbero legarsi alterando il risultato finale. Sempre usando l’ansa, le sezioni vengono trasferite da un pozzetto all’altro; si lasciano cinque minuti in PBS-Tx e un’ora in Block. In seguito si immergono in una soluzione contenente gli anticorpi primari diluiti in Wash (PBS-Tx con 1% di siero), per tutta la notte; gli anticorpi primari utilizzati sono un anticorpo diretto verso la proteina PGP 9.5 (un’idrossilasi dell’ubiquitina espressa in tutti gli assoni a livello del sistema nervoso periferico), che marca le fibre nervose, e un anticorpo diretto verso il collagene di tipo IV, uno dei componenti primari della membrana basale, lo strato che separa epidermide e derma. Ad ogni incubazione, la piastra deve essere riposizionata sull'agitatore, per garantire il movimento dei liquidi nei pozzetti ed impedire che le sezioni di cute aderiscano al fondo. Questa tecnica di IF in cui le sezioni sono immerse nei liquidi reagenti si chiama free-floating.


Il giorno seguente si effettuano tre lavaggi in PBS o in Wash, ognuno di cinque minuti, al fine di eliminare gli anticorpi in eccesso che sono rimasti liberi. Successivamente le sezioni si incubano con gli anticorpi secondari (marcati con due fluorocromi diversi, uno rosso e l’altro verde), anch'essi diluiti in Wash, per tutta la notte. Poiché i fluorofori sono fotosensibili, è opportuno avvolgere la piastra con della carta stagnola.
Il giorno dopo si ripetono i tre lavaggi e si trasferiscono le sezioni sui vetrini. Questa procedura si effettua riempiendo una vaschetta circolare di vetro (capsula Petri) con del PBS, in cui il vetrino sarà in posizione inclinata e parzialmente immerso nella soluzione. Dunque si prelevano le sezioni, si immergono nel PBS e, aiutandosi con l’ansa e con un ago, si collocano sul vetrino osservandole allo stereomicroscopio; bisogna assicurarsi che siano ben distese. Una volta completata l’operazione, i vetrini si lasciano asciugare al buio.
Il giorno successivo si esegue la disidratazione delle sezioni immergendo i vetrini in etanolo al 96% e in etanolo assoluto, per dieci minuti. Poi si passano in xilolo, dove si lasciano per altri dieci minuti. Lo xilolo è una mistura di idrocarburi che serve per eliminare l’alcool e rendere le sezioni traslucide. A questo punto si attua il montaggio del vetrino copri-oggetto, la cui funzione è quella di proteggere le sezioni e di fare in modo che esse si trovino all'interno di un mezzo avente un indice di rifrazione omogeneo, al fine di evitare effetti di rifrazione anomala quando vengono attraversate dalla luce del microscopio. Si procede in questa maniera: su ogni vetrino si applicano tre o quattro gocce di montante, cioè una soluzione vischiosa e trasparente che funziona come una colla (un esempio è il balsamo Eukitt, una miscela di resine acriliche sciolte in xilolo), e si adagia il vetrino copri-oggetto. Al termine del montaggio, i vetrini si tengono al buio fino alla completa asciugatura del montante. Sono pronti per l’analisi al microscopio. Il motivo per cui le sezioni devono essere disidratate è che il montante è apolare, quindi insolubile in acqua.
L’esame microscopico inizia in questo modo: usando un microscopio ottico semplice dotato di fotocamera, si inquadrano le sezioni con l’obiettivo a minore ingrandimento (2,5x), si aggiusta la messa a fuoco e si scatta una foto. Le foto sono necessarie per misurare la superficie lineare dell’epidermide (espressa in millimetri) delle sezioni; tale operazione può essere eseguita mediante qualunque software di image analysis che permetta di tracciare una linea che segue l’andamento del confine tra derma ed epidermide da un’estremità all'altra della sezione (un esempio è ImageJ); tali programmi convertono i pixel in millimetri (mm) (Fig. 5). Terminata questa procedura, si osservano le sezioni in fluorescenza: con l’obiettivo 40x (alto ingrandimento) si inquadra la porzione dove è presente l’epidermide e si contano tutte le fibre nervose che dal derma penetrano nell'epidermide attraversando la membrana basale senza interruzione (Fig. 6). Il numero di fibre nervose contate a livello di una singola sezione viene diviso per i mm di superficie precedentemente calcolati, restituendo un valore di densità dell’innervazione intraepidermica espresso in numero di fibre/mm. Di solito su un vetrino si mettono almeno tre sezioni, e ognuna avrà un valore derivante dal calcolo antecedente; si fa una media dei tre valori per ottenere il risultato finale. Se il valore conclusivo è inferiore rispetto ai valori di riferimento, significa che c’è una riduzione dell’innervazione intraepidermica. I valori di riferimento normativi si basano su ampi dataset già pubblicati, stratificati per età e sesso.
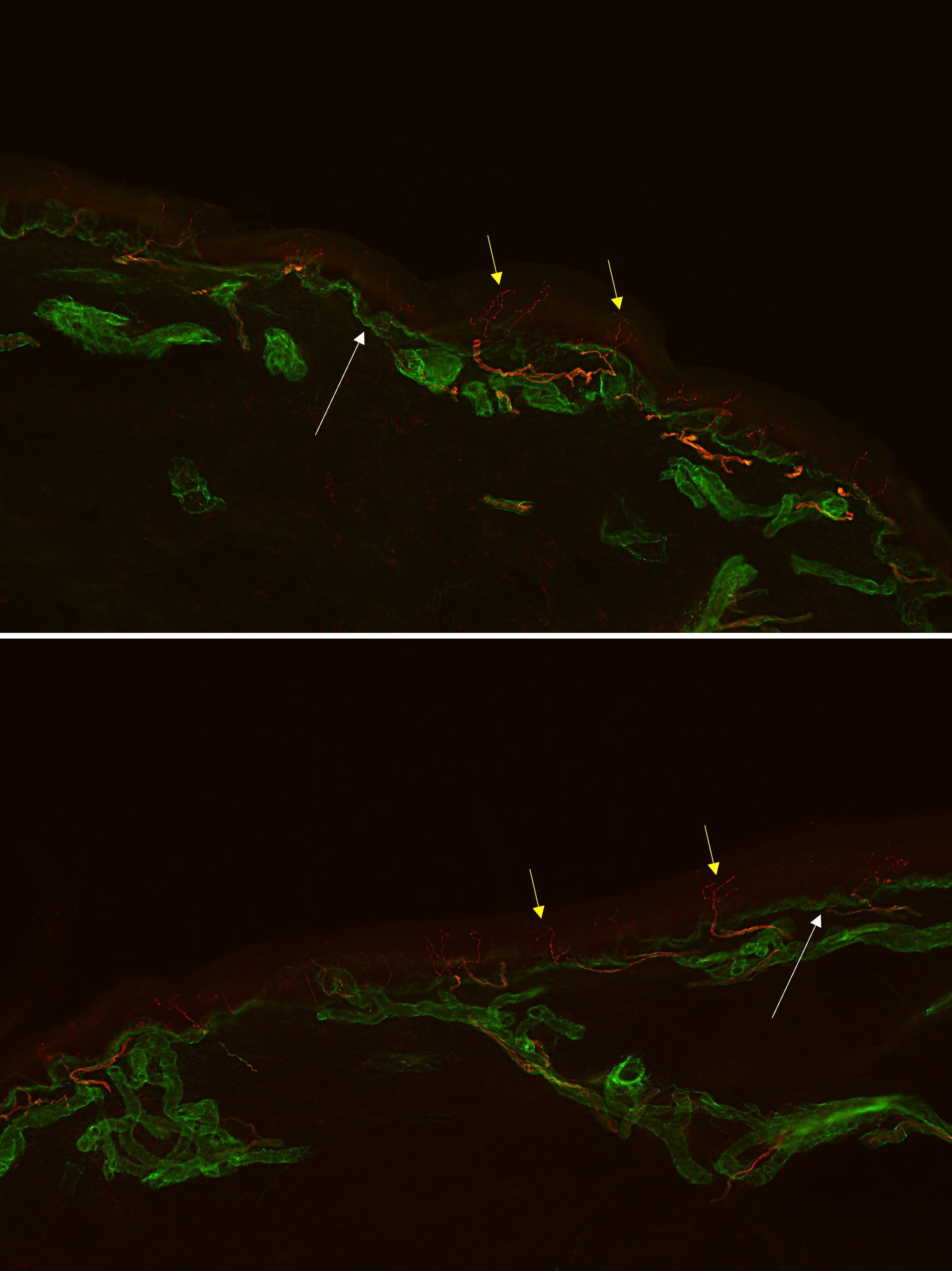
Quando si guardano le sezioni in fluorescenza, è possibile apprezzare anche altre strutture dermiche, tra cui le più rappresentate sono le ghiandole sudoripare eccrine e i muscoli piloerettori, innervati da fibre nervose C autonomiche (Fig. 7 e 8).

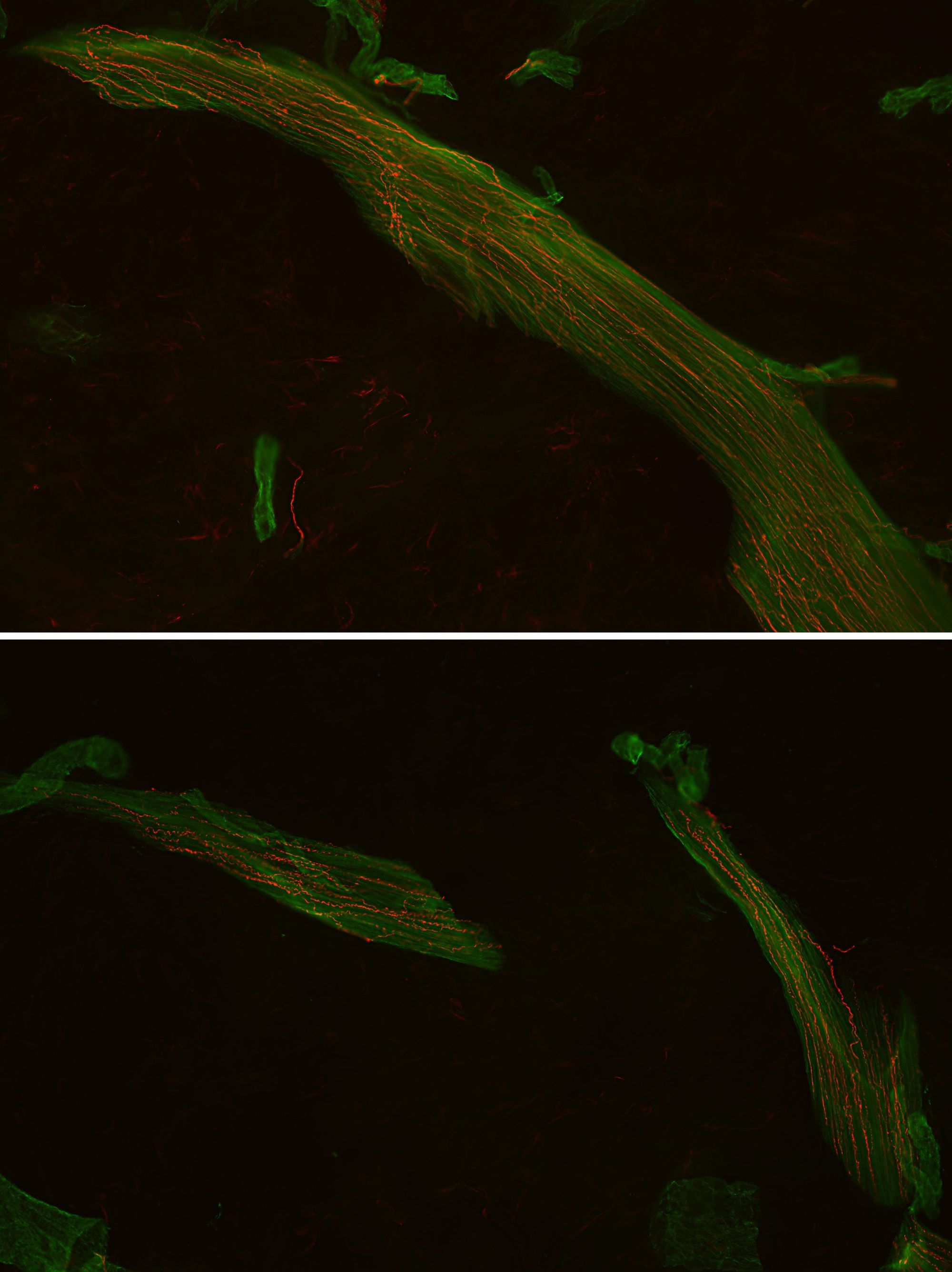
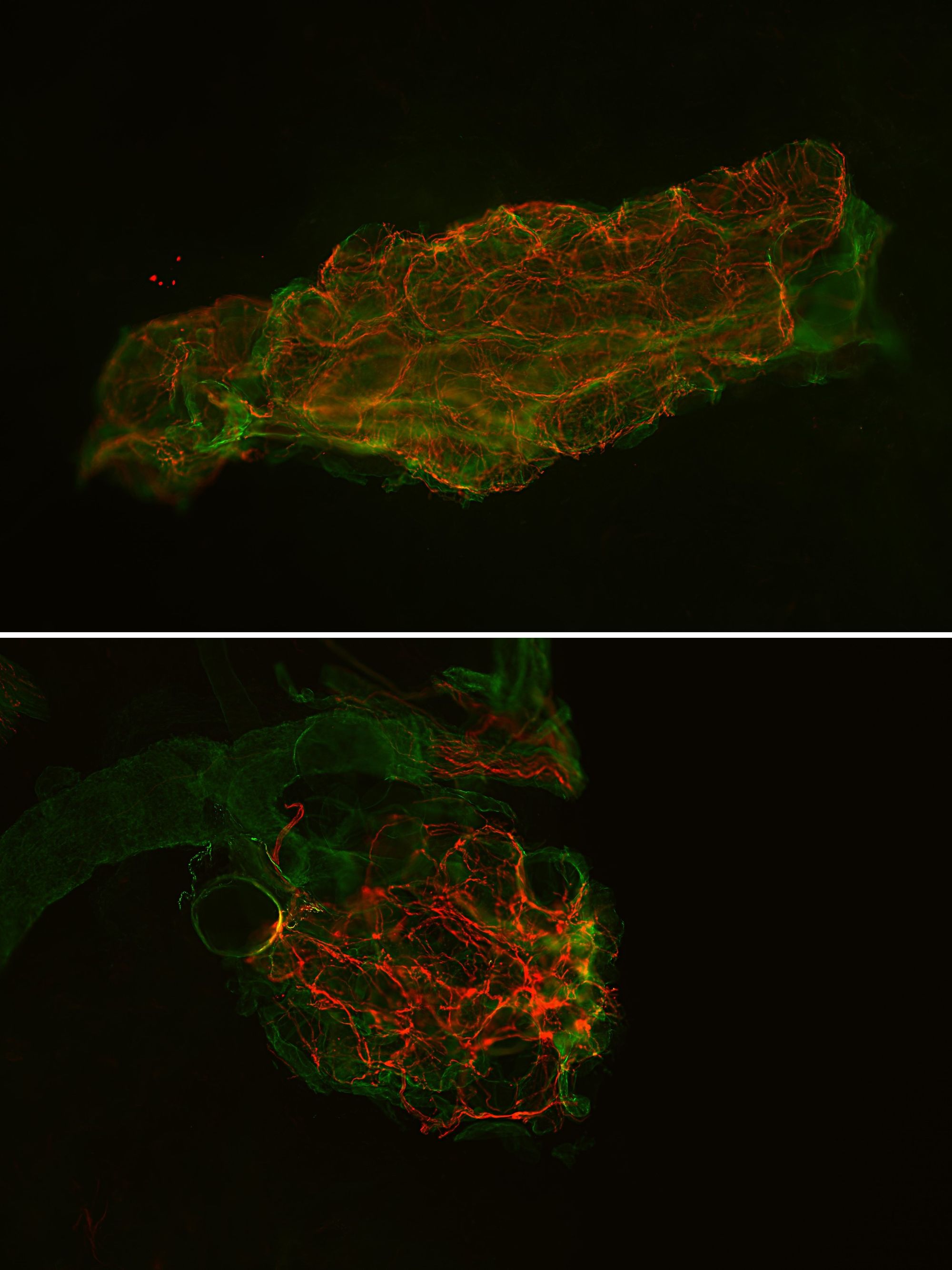
Le indicazioni che abbiamo fornito finora a proposito dell’IF su biopsia di cute sono generiche, ma i protocolli usati dai singoli laboratori possono variare leggermente.
Fase post analitica
In conclusione, si arriva alla creazione del referto, in cui vengono scritti i dati del paziente (nome, cognome, sesso, data di nascita, età), la data dell’esame, le zone del corpo in cui è stata praticata la biopsia, la metodica utilizzata, il valore finale, le conclusioni ed eventuali commenti.
Lorenzo Tramontana
Fonti
- Maria Nolano, Stefano Tozza, Giuseppe Caporaso and Vincenzo Provitera. 2020. “Contribution of Skin Biopsy in Peripheral Neuropathies”, Brain Science;
- Svein Ivar Mellgren, Maria Nolano and Claudia Sommer. 2013. “The cutaneous nerve biopsy: technical aspects, indications, and contribution”, Handbook of Clinical Neurology;
- M. Mücke, H. Cuhls, L. Radbruch, R. Baron, C. Maier, T. Tölle, R. D. Treede and R. Rolke. 2015. "Quantitative sensory testing”, Der Schmerz;
- Vincenzo Provitera, Christopher H. Gibbons, Gwen Wendelschafer-Crabb, Vincenzo Donadio, Dino F Vitale, Adam Loavenbruck, Annamaria Stancanelli, Giuseppe Caporaso, Rocco Liguori, Ningshan Wang, Lucio Santoro, William R. Kennedy and Maria Nolano. 2018. “The role of skin biopsy in differentiating small fiber neuropathy from ganglionopathy”, European Journal of Neurology;
- Luigi Ruco e Aldo Scarpa. 2007. “Anatomia patologica. Le basi”, UTET;
- https://www.inpha.it/it-it/Patologie/Dettaglio/ArticleID/12/Neuropatie-periferiche;
- https://www.issalute.it/index.php/la-salute-dalla-a-alla-z-menu/n/neuropatie-periferiche#sintomi;
- https://www.mayoclinic.org/tests-procedures/skin-biopsy/multimedia/punch-biopsy/img-20005764;
- https://www.fishersci.com/shop/products/zamboni-s-fixative-1l/NC9335034;
- https://www.medicalexpo.it/fabbricante-medico/microtomo-criostato-automatico-15556.html;
- https://www.optikascience.com/optikascience/product/sfx-91d-stereomicroscopio-digitale-braccio-fisso-10x-20x-40x-pannello-di-controllo-touch-3-2-mp-camera-batteria-ricaricabile/.
Ti è piaciuto l'articolo?
 BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
