Patologie da brivido: le febbri emorragiche virali
🤒 Le febbri emorragiche sono un gruppo di patologie distinte da un esordio improvviso e da sanguinamenti in varie parti del corpo. In questo articolo ci focalizzeremo su quelle causate da virus, in particolare da Ebola virus, Marburg virus, virus della febbre di Crimea-Congo e Lassa virus.

Introduzione
L’espressione “febbri emorragiche” indica un gruppo di patologie distinte da un esordio improvviso e dalla presenza di sanguinamenti in varie parti del corpo, tra cui il naso, la bocca e gli organi interni. In questo articolo ci focalizzeremo su quelle causate da virus, in particolare da Ebola virus, Marburg Marburgvirus, virus della febbre di Crimea-Congo e Lassa virus, che rappresentano quelli più assiduamente associati alle febbri emorragiche. Si tratta di malattie classificate come zoonosi, dal momento che i virus risiedono in animali ma accidentalmente possono infettare gli esseri umani; sono altamente contagiose, si manifestano con sintomi come febbre, dolori muscolari, cefalea, vomito e diarrea, e di frequente hanno un esito fatale.
Virus Ebola
L’Ebola virus (EVD) raffigura un genere di virus appartenente alla famiglia Filoviridae e include cinque specie, ossia Bundibugyo ebolavirus (BDBV), Zaire ebolavirus (EBOV), Reston ebolavirus (RESTV), Sudan ebolavirus (SUDY), Taї Forest ebolavirus (TAFV), Bombali ebolavirus (BOMV). La prima apparizione di questi virus risale al 1976 nella Repubblica Democratica del Congo (a quei tempi Zaire), in un villaggio vicino al fiume Ebola, e nel Sudan meridionale, a Nzara e a Maridi, dove si verificarono le prime epidemie; i casi segnalati furono 360 in Sudan e 237 nello Zaire. Un’altra epidemia avvenne il 22 marzo 2014, nella quale il virus si diffuse dalla Guinea in Liberia, Sierra Leone, Nigeria, Senegal e Mali; il numero dei contagi fu considerevolmente elevato, e in quasi due anni si registrarono 28.652 casi sospetti, 15.261 casi confermati e 11.325 decessi. Bisogna rimarcare che tra le cinque specie elencate, quelle responsabili di grandi epidemie sono EBOV, SUDY e BDBV, mentre RESTV (trovato nelle Filippine e nella Repubblica popolare cinese), BOMV (scoperto nei pipistrelli dalla coda libera di Angola, nella parte nord di Sierra Leone, a Bombali) e TAFV (identificato negli scimpanzé della foresta Tai in Costa d’Avorio) non sono in grado di indurre malattie gravi o decesso.
La trasmissione avviene in seguito al contatto con sangue e fluidi corporei (saliva, sudore, urina, liquido seminale, feci, vomito, latte materno) di persone malate o decedute a causa del virus, oggetti contaminati (vestiti, aghi, attrezzature sanitarie, biancheria da letto) e animali infetti. Non si conosce precisamente il serbatoio naturale del virus Ebola, ma si suppone che sia il pipistrello della frutta della famiglia Pteropodidae. In ogni caso, l’infezione è stata attestata in seguito alla vicinanza con altri animali come scimpanzé, gorilla, antilopi, istrici e porcospini.
Al livello strutturale l’EVD è composto da un pericapside (envelope) di lipidi e glicoproteine e un nucleocapside proteico che racchiude il genoma a RNA a singolo filamento negativo, e presenta una forma che può essere filamentosa, circolare, a lettera U o a numero 6 (Fig. 1A). Il genoma contiene 18-19 kilobasi (kb) e codifica per sette proteine strutturali, cioè la nucleoproteina (NP), la glicoproteina di superficie (GP), le quattro proteine del nucleocapside [VP24, VP30 (attivatore trascrizionale), VP35 (cofattore della polimerasi) e VP40] e l’enzima RNA polimerasi-RNA dipendente (L) (Fig. 1B).
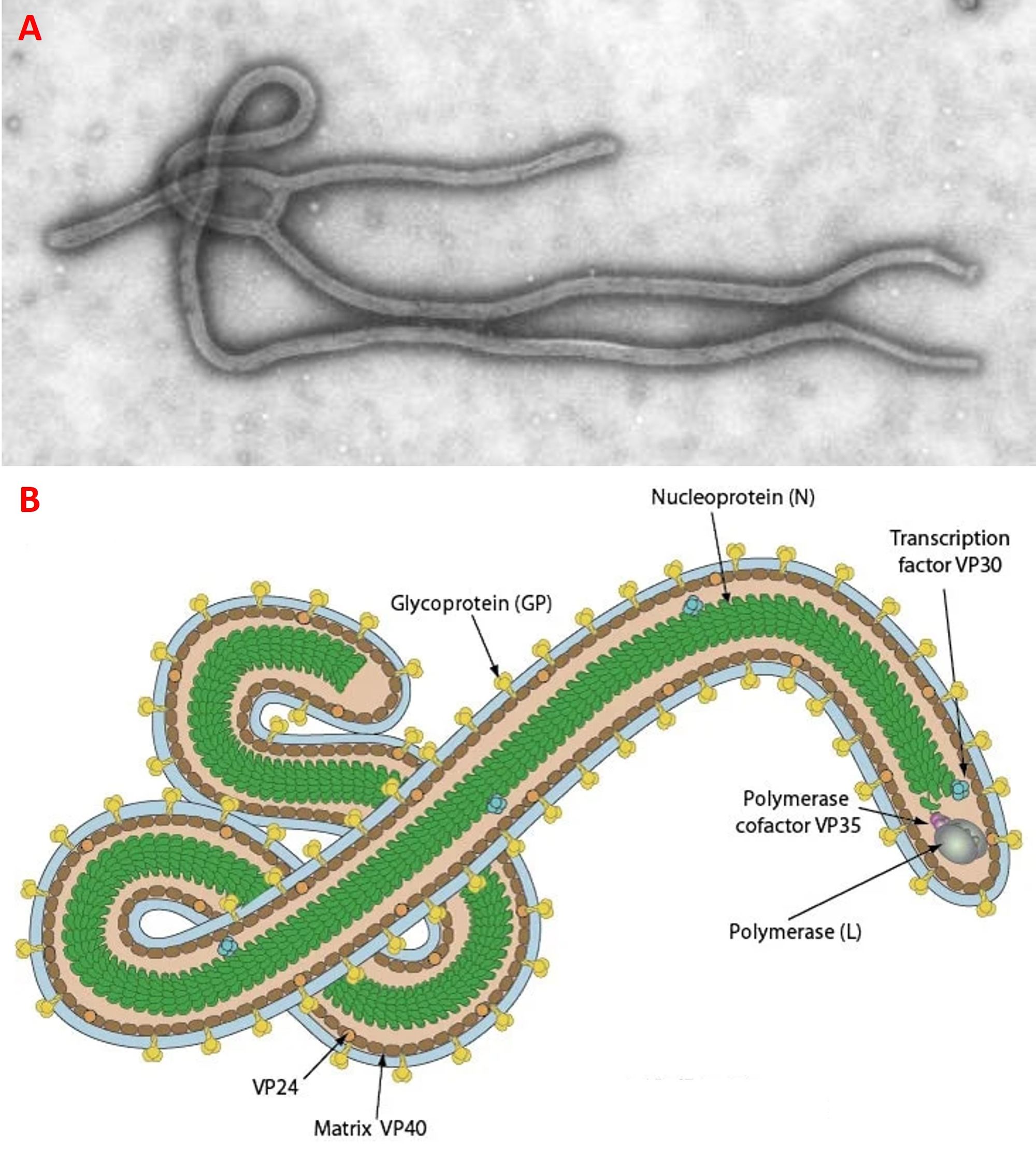
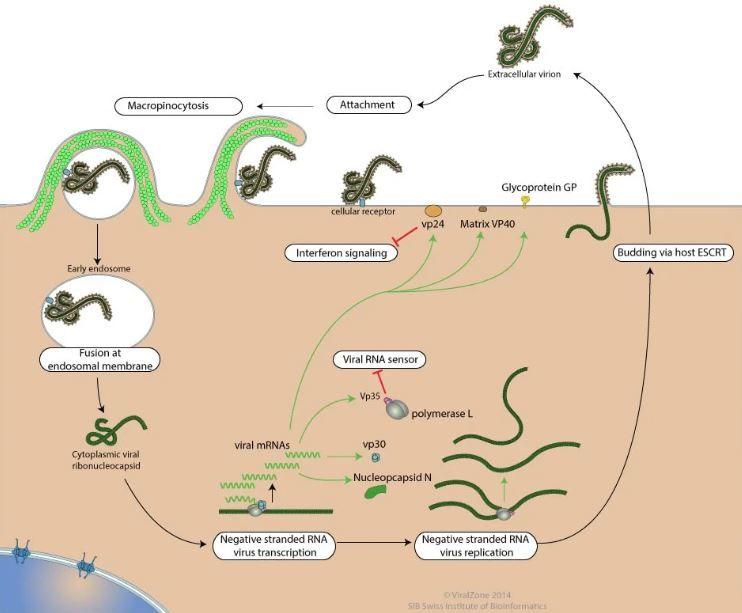
Dal punto di vista della replicazione, l’EVD ha un ampio tropismo tissutale e può infettare una cospicua varietà di cellule epiteliali (cellule polmonari, cheratinociti, epatociti, endoteliociti) e immunitarie (macrofagi, cellule dendritiche e cellule di Kupffer), alle quali si attacca tramite la glicoproteina, che interagisce con l’eparan solfato, un mucopolisaccaride acido presente sulla superficie di molteplici cellule da cui penetra attraverso endocitosi mediata da recettore; la conseguente fusione della membrana dell’endosoma con quella del virus comporta la liberazione, nel citoplasma della cellula, del genoma virale, che viene trascritto in mRNA dalla polimerasi L. Successivamente l’mRNA viene tradotto nelle diverse proteine codificanti, alcune delle quali si assemblano per creare il nucleocapside, mentre quelle del pericapside (GP e VP40) si collocano sulla membrana cellulare. A questo punto i virus neoformati vengono rilasciati dalla cellula grazie all’intervento delle proteine ESCRT (endosomal sorting complex required for transport); escono dalla cellula per gemmazione prendendo una porzione della membrana (nella zona dove sono presenti le GP), che andrà a costituire l’envelope virale. L’intero processo è riassunto in figura 2.
L’infezione da EVD ha un’incubazione che va da 2 a 21 giorni e all’inizio si manifesta con febbre, debolezza, malessere, cefalea, mal di gola e mialgie, che raffigurano i sintomi precoci. In seguito, compaiono anoressia, nausea, vomito, dolore addominale, diarrea, eruzione esantematica, alterazioni delle funzioni renale, epatica e respiratoria. In alcune circostanze si presentano anche shock, convulsioni, ittero ed emorragie interne ed esterne (con conseguente ematemesi, melena, petecchie, epistassi, ematuria, emorragie sottocongiuntivali e gengivali). Sovente la malattia porta al decesso, e la possibilità di guarigione dipende da un supporto clinico idoneo e dalla risposta immunitaria del paziente. Dopo la guarigione, la febbre può continuare per vari giorni, il virus rimane in alcuni siti corporei come testicoli, interno occhi, placenta e sistema nervoso centrale per un lasso di tempo ancora sconosciuto, e il paziente necessita di una convalescenza prolungata al fine di riacquistare peso e forza. Nel caso in cui la malattia colpisce donne in gravidanza, c’è un alto rischio di aborto spontaneo.
Marburg marburgvirus
Il Marburg marburgvirus (MARV) rappresenta il primo membro della famiglia Filoviridae ad essere scoperto; la prima identificazione avvenne nel 1967 nella città di Marburgo, in Germania, quando all’interno di un laboratorio dove si lavorava con le colture cellulari si verificò un’epidemia che colpì 37 membri del personale (7 casi furono mortali). La causa era legata alla manipolazione di cellule renali, provenienti da scimmie verdi ugandesi (Cercopithecus aethiops), allo scopo di creare un vaccino contro la poliomielite. All’inizio la patologia venne denominata “malattia delle scimmie verdi”. Ci furono poi altri episodi, di cui uno nel 1975 in Sudafrica, a Johannesburg, che coinvolse un giovane di ritorno dallo Zimbabwe, il quale contagiò una ragazza che era andata insieme a lui e un’infermiera che aveva assistito entrambi. Mentre le due donne si salvarono, egli decedette. Altri due casi si verificarono in Kenya, tra il 1980 e il 1987, dove un uomo francese di 56 anni e un ragazzo danese di 15 non riuscirono a sopravvivere. Nella Repubblica Democratica del Congo, tra il 1998 e il 2000, scoppiò un’epidemia in cui su 154 persone che si ammalarono, 128 morirono; i focolai maggiori erano localizzati nella miniera d’oro di Durba e nel villaggio di Watsa. Nel 2007, in Gabon, l’isolamento del virus nel megachirottero africano (Rousettus aegyptiacus) e le varie analisi filogenetiche stabilirono che tale pipistrello raffigurava il serbatoio naturale del virus. Tale teoria venne supportata anche dalla presenza di megachirotteri sani infettati dal virus nella miniera di Kitaka in Uganda e nella miniera di Goroumbwa nella Repubblica Democratica del Congo.
Al livello epidemiologico, la patologia è diffusa soprattutto in Angola, nella Repubblica Democratica del Congo e in Uganda. La trasmissione del virus avviene nella stessa maniera dell'EVD.
La struttura del MARV è molto simile a quella dell’EVD; presenta una forma principalmente a bastoncello, ma può assumere anche una sagoma a U o a 6, è costituito da un envelope, un capside a simmetria elicoidale e un nucleocapside contenete un singolo filamento di RNA a polarità negativa di 19 kb, che codifica per le seguenti proteine: nucleoproteina (NP), glicoproteina (GP), RNA polimerasi RNA dipendente (L), VP30, VP24, VP35 e VP40 (Fig. 3).
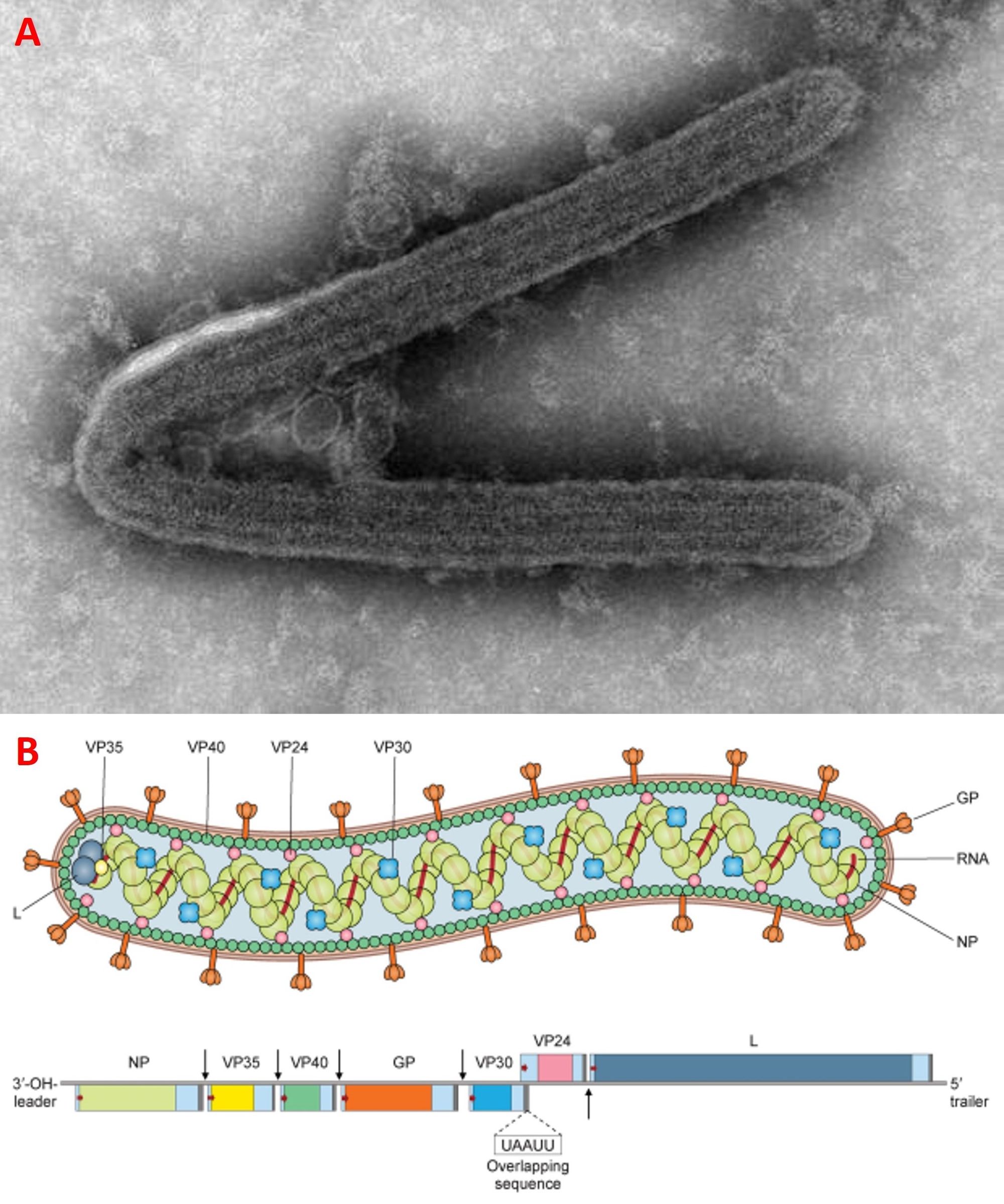
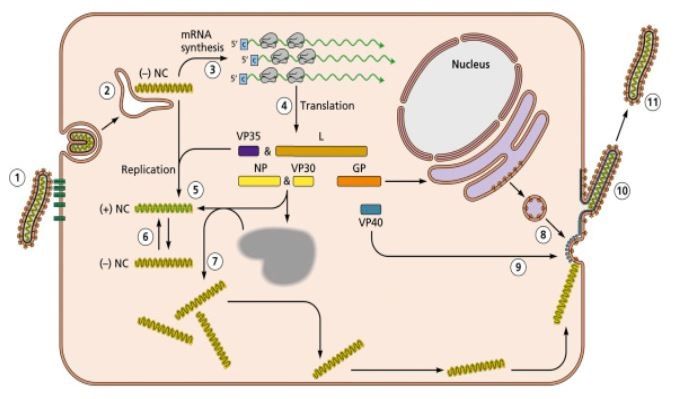
Per quanto concerne la replicazione, innanzitutto c’è da dire che il MARV riesce a infettare quasi ogni tipo di cellula, a cui si lega mediante la glicoproteina. Non si conosce esattamente la molecola con cui interagisce, ma sono stati identificati vari potenziali mediatori, tra cui i recettori a tirosina chinasi, le lectine di tipo C e l’NPC1 (trasportatore intracellulare del colesterolo). Come per l’EVD, dopo l’adesione il virus viene internalizzato tramite endocitosi, seguita dalla liberazione del genoma nel citoplasma cellulare, dalla trascrizione, la traduzione, l’assemblaggio e il rilascio dei nuovi virioni per gemmazione (Fig. 4).
La malattia di Marburg, chiamata anche febbre emorragica di Marburg (MHF), consiste in tre fasi, ovvero la fase di generalizzazione, la fase dell’organo precoce e la fase di convalescenza. Dopo un periodo di incubazione cha va da 2 a 20 giorni, i sintomi della prima fase includono sindrome simil-influenzale, febbre alta (39-40°C), fatica, inappetenza, calo ponderale, dolore addominale, nausea, vomito, diarrea acquosa, anoressia, emicrania, mialgia, brividi e malessere. Verso la fine di questa fase, che dura cinque giorni, compaiono congiuntivite, disfasia, faringite, eruzione maculo-papulare, linfoadenopatia, leucopenia (diminuzione dei globuli bianchi) e trombocitopenia (riduzione delle piastrine).
Nella seconda fase, che può durare fino a trenta giorni, insorgono infezione congiuntivale, prostrazione, dispnea, esantema virale, alterazione della permeabilità dei vasi sanguigni con conseguente edema. In aggiunta a ciò, si possono avere sintomi neurologici come stato confusionale, encefalite, irritabilità, delirio e aggressione, e manifestazioni emorragiche come melena, petecchie, ecchimosi, ematemesi, sanguinamenti dal naso e dalle gengive. Poiché le emorragie non colpiscono tutti i pazienti, la patologia viene chiamata MHF solo quando compaiono tali sintomi.
L’ultima fase può avere due esiti, cioè l’infezione diventa fatale oppure si entra in un lungo periodo di convalescenza; le circostanze che conducono al decesso sono gravi disturbi metabolici, convulsioni ed elevata disidratazione, che portano all’insufficienza multiorgano e all’anuria. In questa fase persistono i disturbi neurologici, possono insorgere orchite, mialgia, amnesia parziale, sudorazione e screpolatura nelle zone affette da eruzione esantematica. Alcune complicazioni sono artralgia, epatite, astenia, problemi oculari, psicosi e aborto spontaneo.
Virus della febbre di Crimea-Congo
Il virus della febbre di Crimea-Congo (CCHFV) è un virus appartenente alla famiglia Bunyaviridae e al genere Nairovirus, viene trasmesso dalle zecche, in particolare quelle del genere Hyalomma, che fungono sia da serbatoi che da vettori primari, e può infettare una vasta quantità di animali selvatici e domestici come piccoli roditori, lepri, struzzi, bufali, rinoceronti, bovini, pecore e capre; negli animali il virus rimane in maniera transitoria nel flusso ematico (circa una settimana) e non provoca la malattia. Gli esseri umani possono essere contagiati sia dalla puntura delle zecche sia stando a contatto con tessuti e fluidi corporei di animali infetti, e proprio per questo gli allevatori, i macellai e i veterinari sono tra le persone più a rischio. La trasmissione può essere anche interumana in seguito al contatto con fluidi corporei di persone affette.
I paesi in cui la CCHF è endemica sono l’Africa, i Balcani, il Medio Oriente e l’Asia occidentale. La malattia venne descritta per la prima volta nel 1944 nella penisola di Crimea, dove aveva colpito i contadini e i soldati, e fu chiamata febbre emorragica di Crimea. Nel 1969 si dimostrò che l’agente eziologico era il medesimo che aveva indotto la malattia in un bambino congolese nel 1956. Il legame tra i due luoghi spinse a cambiare il nome della patologia in febbre emorragica di Crimea-Congo.
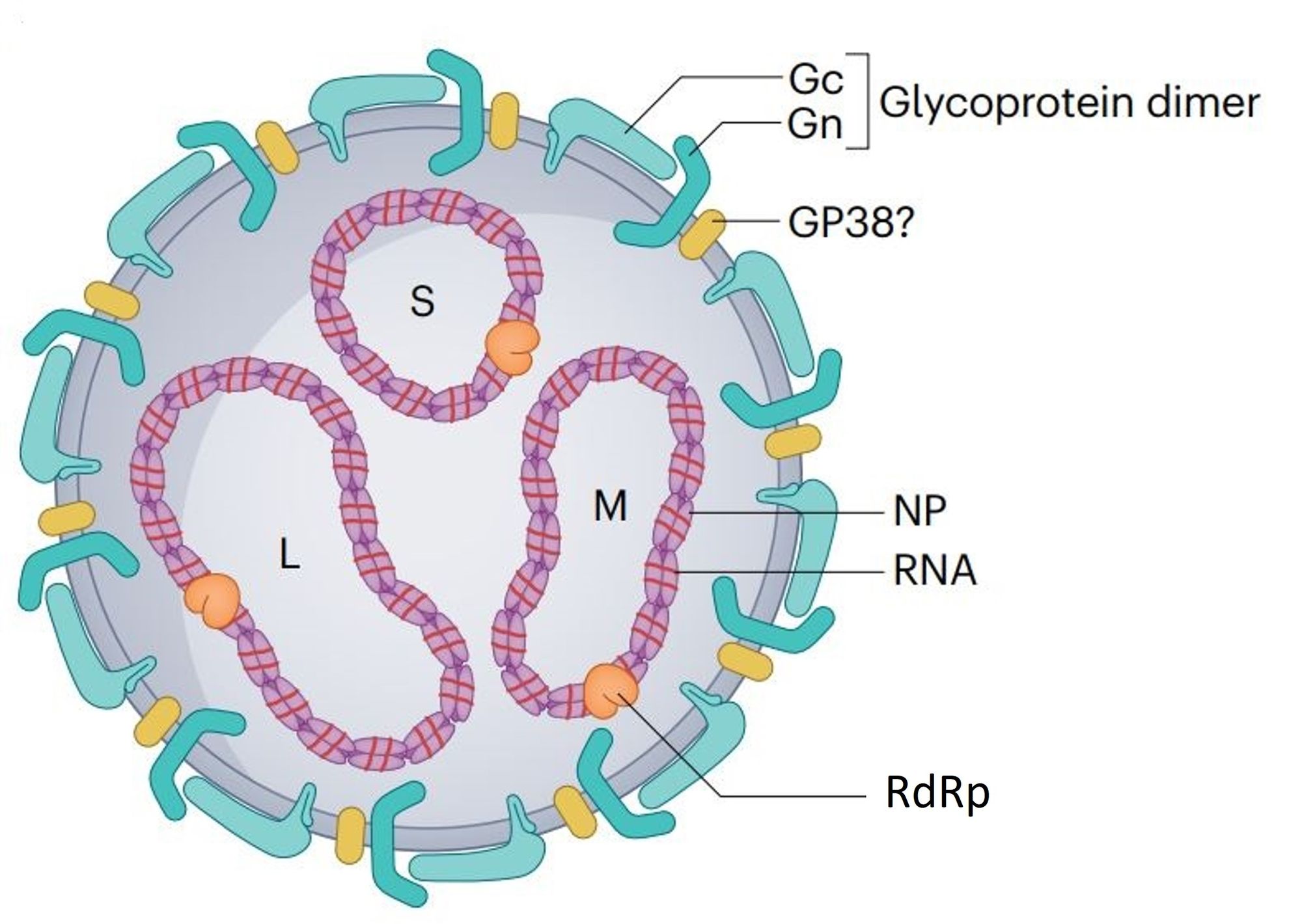
Il CCHFV ha una forma sferoidale, misura 80-100 nm di diametro, e gli elementi principali che lo costituiscono sono il pericapside, sulla cui superficie sono presenti le glicoproteine Gn e Gc, importanti per l’attaccamento e l’entrata nelle cellule, il genoma formato da tre filamenti di RNA a polarità negativa, uno piccolo (S) di circa 1,6 kb, uno medio (M) di circa 5,4 kb e uno grande (L) di circa 12,1 kb, e la nucleoproteina (NP) che racchiude il genoma. Il segmento S codifica per la nucleoproteina, il segmento M per il precursore delle glicoproteine, e il segmento L per l’RNA polimerasi RNA dipendente (RdRp) (Fig. 5). L’RNA virale, la nucleoproteina e la polimerasi formano i complessi della ribonucleoproteina genomica (RNP).
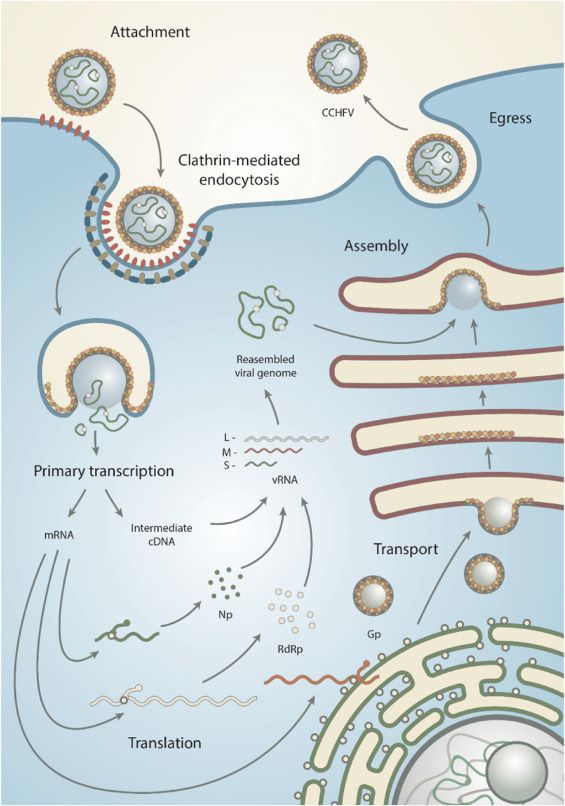
Il ciclo del CCHFV inizia con l’adesione alla cellula, prosegue l’endocitosi mediata dalla clatrina (componente delle membrane cellulari), la formazione dell’endosoma che racchiude il virus, la fusione dell’envelope virale con la membrana dell’endosoma, con consecutivo rilascio dei segmenti di RNA nel citoplasma. Questi vengono trascritti in mRNA e tradotti, le proteine virali neosintetizzate si assemblano per generare nuovi virioni, che escono dalla cellula mediante esocitosi (Fig. 6). Al fine di favorire la replicazione, la nucleoproteina inibisce l’apoptosi (morte cellulare programmata) e le vie di segnalazione che attivano la risposta immunitaria.
La patogenesi da CCHFV è caratterizzata da quattro fasi, ovvero incubazione, pre-emorragica, emorragica e convalescenza. La prima dura da uno a nove giorni, a seconda della carica virale iniettata dal vettore; la seconda va da due e quattro giorni ed esordisce con sintomi aspecifici come febbre, emicrania, mialgie, vertigini, rigidità e dolore al collo, alla schiena e agli occhi, e fotofobia. Oltre a ciò, i pazienti possono lamentare anche mal di gola, dolori addominali, nausea, vomito e diarrea. Nei casi più gravi sono stati segnalati cambiamenti d’umore e alterazione della percezione sensoriale. Ulteriori sintomi possono essere arrossamento del viso, del collo e del torace, congestione della sclera, congiuntivite, ittero, splenomegalia ed epatomegalia.
La terza fase in genere è corta, circa due o tre giorni, anche se può prolungarsi fino a due settimane, e le manifestazioni emorragiche sono in prevalenza petecchie, ecchimosi, epistassi, melena, ematemesi, ematuria ed emottisi. Gli esami ematologici evidenziano spesso trombocitopenia, leucopenia e alti livelli delle transaminasi (ALT e AST), del lattato deidrogenasi, della creatina chinasi e delle citochine pro-infiammatorie. La coagulazione è compromessa con abbassamento del fibrinogeno, prolungato tempo di protrombina, aumento dei livelli dei prodotti di degradazione della fibrina (D-dimero). Nei casi più severi la situazione evolve verso la coagulazione intravascolare disseminata che comporta insufficienza epatica, renale o polmonare, e shock. Di solito la morte avviene nella seconda settimana di malattia, e riguarda all’incirca il 30% dei casi.
L’ultima fase, in coloro che sopravvivono alla terza, inizia normalmente nove o dieci giorni dall’inizio della patologia ed è distinto dal ripristino dei parametri di laboratorio ai valori fisiologici. Tale fase può essere associata con ipotensione, tachicardia o bradicardia, polineurite, problemi di respirazione, xerostomia (secchezza della mucosa orale), deficit nella vista e nell’udito, perdita dei capelli e della memoria.
Lassa virus
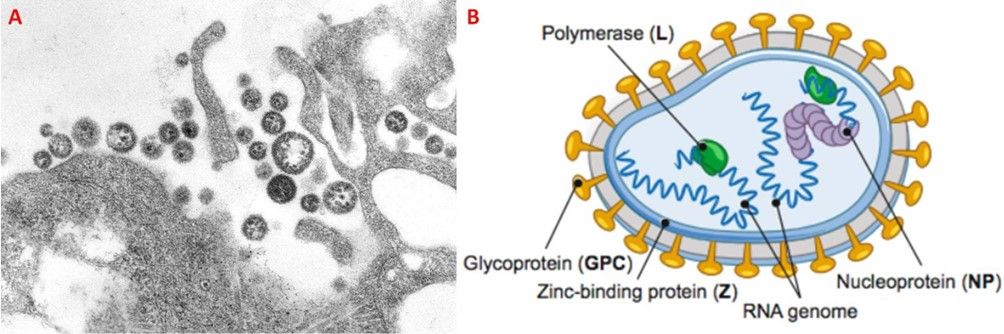
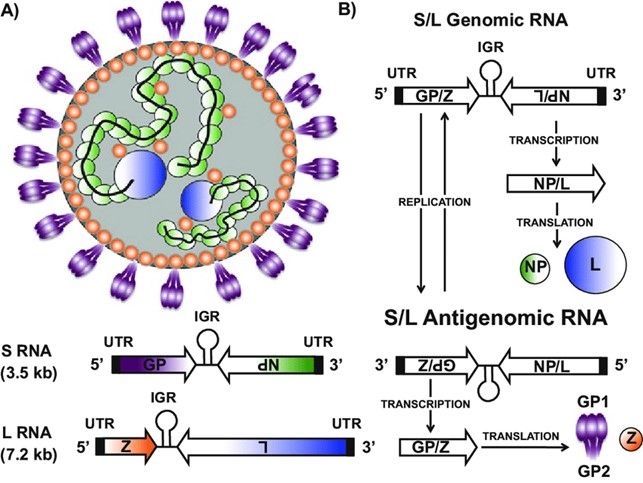
Il Lassa virus (LASV), chiamato anche Lassa mammarenavirus (LMV), è un virus incluso nella famiglia Arenaviridae, è distinto da un pericapside sferoidale che misura tra 70 e 150 nm, e da un genoma formato da due segmenti di RNA a polarità negativa, uno più grande (L) di circa 7,3 kb e uno più piccolo (S) di circa 3,5 kb. Il primo codifica per la proteina con motivi a dita di zinco (Z) e l’enzima RNA-polimerasi-RNA-dipendente (L), mentre il secondo codifica per il precursore della glicoproteina di superficie (GPC) e la nucleoproteina (NP) (Fig. 7). Di frequente all’interno del virus si osservano dei granuli elettrondensi, che corrispondono ai ribosomi della cellula ospite, da cui proviene il nome “arena”, che significa sabbia (Fig. 7A).
Il LASV rappresenta l’agente eziologico della febbre emorragica di Lassa, una grave malattia endemica in Nigeria, Sierra Leone, Liberia, Guinea, Gabon, Togo, Benin, Mali e Ghana, dove annualmente si registrano più di 300.000-500.000 infezioni e 5000-10.000 casi fatali di febbre di Lassa. Tuttavia, l’Africa non è l’unico luogo in cui si verificano dei casi, dal momento che alcuni sono stati segnalati anche negli Stati Uniti d’America e in Europa (Svezia, Germania e Gran Bretagna). I serbatoi naturali del virus sono i roditori di varie specie, tra cui Mastomys natalensis (topo multimammato), M. erythroleucus (ratto a mammelle multiple), Hylomyscus pamfi e Mus baoulei (topo pigmeo), i quali sono sensibilmente fecondi, vivono nella savana e nelle foreste africane, e spesso possono trovarsi all’interno delle abitazioni umane. Questi roditori ospitano il virus senza ammalarsi e lo emettono con la saliva, le urine e le feci.
La prima relazione sulla febbre emorragica da arenavirus risale agli anni 50 con l’isolamento del Junin virus (responsabile della febbre emorragica argentina) nel 1958, seguito dalla scoperta del Machupo virus (che causa la febbre emorragica boliviana) nel 1965. L’identificazione del LASV si realizzò nel 1969, e il nome deriva da quello della città di Lassa, presente nella regione nigeriana del Borno, in cui si registrarono i primi casi.
Nella replicazione del LASV giocano un ruolo importante le due glicoproteine dell’envelope, GP1 e GP2, coinvolte rispettivamente nell’interazione con i recettori cellulari e l’ingresso nella cellula ospite. Queste hanno una forma a T e originano dal precursore GPC attraverso un taglio proteolitico da parte di una proteasi. Sotto al pericapside è collocato uno strato formato dalla proteina con motivi a dita di zinco (Z), la quale è coinvolta nell’assemblaggio e nella gemmazione dei nuovi virioni. Nel core del virus sono presenti due complessi di ribonucleoproteine virali (vRNPs) composti dai segmenti genomici racchiusi dalla nucleoproteina virale (NP) (Fig. 8A). L’interazione tra la proteina Z e la NP media l’integrazione delle vRNPs nei virioni; i processi di replicazione del genoma virale e trascrizione dei geni richiedono la polimerasi, associata ai due vRNPs.
Le prime fasi del ciclo biologico del LASV sono l’accostamento tra gli antirecettori virali (GP1 e GP2) e i recettori della cellula ospite, l’ingresso nella cellula mediante endocitosi e la rimozione del rivestimento proteico con successiva liberazione nel citoplasma del genoma, che andrà incontro a duplicazione, trascrizione e traduzione.
Il virus interagisce con la glicoproteina di membrana alfa-distroglicano, che lega la matrice extracellulare. Questa molecola è espressa su un’ampia gamma di cellule, tra cui le cellule dendritiche, i macrofagi, gli endoteliociti e le cellule muscolari scheletriche. Queste ultime, però, non raffigurano il maggiore bersaglio del LASV, e ciò potrebbe essere legato a un blocco dell’adesione e della replicazione del virus.
I due filamenti di RNA utilizzano la strategia di codifica ambisenso, allo scopo di indirizzare la creazione delle due proteine virali in direzione opposta. La polimerasi avvia la trascrizione dal promotore virale, posizionato nella regione non codificante (UTR) presente all’estremità 3’ dell’RNA virale. La trascrizione primaria permette la sintesi della nucleoproteina e degli RNA messaggeri (mRNA). Il termine della trascrizione avviene grazie alla regione intergenica (IGR), una struttura ad ansa che si trova in entrambi i filamenti di RNA, situata in mezzo ai due geni virali. In seguito, la polimerasi si muove attraverso la regione IGR al fine di generare una copia completa dei due RNA virali antigenomici, adibiti a stampi per la produzione degli mRNA codificanti per le proteine GP e Z. La figura 8B riassume in maniera approssimativa i processi di replicazione, trascrizione e traduzione del genoma virale.
L’intero ciclo biologico del virus si compie nel citoplasma della cellula infetta. Una volta completati la sintesi e l’assemblaggio delle proteine virali, i nuovi virioni sono rilasciati all’esterno mediante gemmazione, prendendo una porzione della membrana cellulare, dalla quale ha origine il pericapside (Fig. 9).
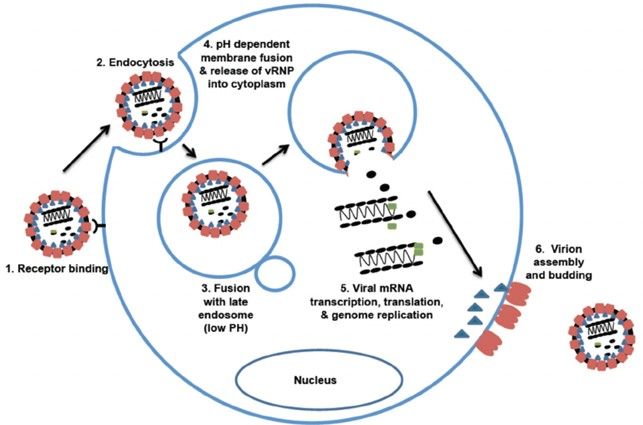
Le persone possono essere contagiate dal LASV in diversi modi: mediante il contatto con feci e urine degli animali serbatoi, il contatto con sangue, urine, feci e secrezioni corporee di persone affette, l’ingestione di acqua o cibi inquinati da escrementi di roditori portatori del virus, l’infezione di ferite o piaghe, la manipolazione di oggetti contaminati, l’inalazione di aerosol contenenti il virus. Esiste anche la trasmissione attraverso rapporti sessuali.
La febbre di Lassa non ha distinzioni dal punto di vista dell’età e del sesso, e colpisce specialmente gli individui che risiedono in aree campestri abitate da roditori del genere Mastomys. Il rischio è più elevato nelle comunità dove c’è assembramento e l’igiene è inadeguata.
Nell’80% degli episodi l’infezione è asintomatica o con sintomi lievi. In altri casi, invece, la patologia è caratterizzata da un periodo di incubazione che va da una a tre settimane, e insorge con sintomi aspecifici, cioè febbre, debolezza, mal di gola con comparsa di chiazze di essudato bianco o giallastro sulle tonsille, malessere, tosse, cefalea, dolore toracico, mialgia e artralgia. Questi segni sono seguiti da manifestazioni a livello dell’apparato gastroenterico, tra cui dolore addominale, nausea, vomito, diarrea ed epigastralgia (dolore alla bocca dello stomaco).
Nei casi più critici, trascorsa la prima settimana si manifestano edema facciale, emorragie nasali, orali, vaginali e gastrointestinali, versamento pleurico, shock, coinvolgimento neurologico con perdita dell’udito, tremori ed encefalite, insufficienza multiorgano, leucopenia, trombocitopenia e proteinuria (presenza di proteine nelle urine). Più tardi possono emergere disorientamento, convulsioni e coma. Il decesso avviene in un lasso di tempo di 14 giorni dalla comparsa dei segni clinici, e il tasso di mortalità è suppergiù dell’1%, anche se nei casi più severi può raggiungere il 15-20%. Tali valori salgono ulteriormente durante le epidemie, fino a interessare il 50% delle persone ospedalizzate.
La maggior parte degli individui affetti (60-80%) presenta una pressione sistolica minore di 90 mmHg e relativa bradicardia. Nel 10-30% dei pazienti insorgono ingrossamento del volto e del collo, e gonfiore della congiuntiva, mentre circa un terzo delle persone che sopravvivono può andare incontro a complicazioni come la sordità neurosensoriale, che sovente è perenne.
Nella fase di guarigione possono esserci perdita dei capelli e problemi temporanei della deambulazione.
La febbre di Lassa è decisamente rischiosa negli stadi avanzati della gestazione (specialmente durante il terzo trimestre) e può provocare la morte della madre e/o la perdita del feto. Fattori aggiuntivi che rendono la prognosi sfavorevole sono lo shock, le emorragie, i sintomi neurologici, l’alta viremia e i livelli dell’enzima epatico aspartato amminotransferasi maggiori di 150 IU/L.
Diagnosi
Dal momento che le febbri emorragiche virali si somigliano dal punto di vista dei sintomi e possono essere confuse con febbri indotte da microorganismi differenti (malaria, leptospirosi, febbre tifoide, febbre gialla, febbre dengue, brucellosi), la diagnosi non è semplice. Oltre a richiedere un esame obiettivo, un’attenta anamnesi per avere informazioni sugli ultimi viaggi effettuati dal paziente, necessitano di specifici esami di laboratorio, tra cui il dosaggio degli anticorpi mediante test ELISA (saggio immuno-assorbente legato a un enzima), immunofluorescenza o saggio della siero-neutralizzazione, ricerca del genoma virale tramite test molecolari come la PCR (reazione a catena della DNA polimerasi), microscopia elettronica e isolamento del virus in colture cellulari. Gli ultimi due si adoperano essenzialmente a scopo di ricerca, in quanto sono più lunghi e laboriosi.
I test diagnostici elencati sono associati anche a esami ematologici e urinari, allo scopo di evidenziare alterazioni nei livelli di leucociti e piastrine, innalzamento dei valori di enzimi come transaminasi e lattato deidrogenasi e presenza di proteine nelle urine.
Terapia e profilassi
Non tutte le febbri emorragiche virali hanno una terapia specifica, per la febbre di Lassa si utilizza la ribavirina, un analogo della guanosina che agisce interferendo con la replicazione dell’RNA virale. In ogni caso, queste malattie richiedono una terapia di supporto che consiste in trasfusioni per mantenere il volume ematico, somministrazione di liquidi ed elettroliti per il bilancio idrico ed elettrolitico, somministrazione di fattori di coagulazione nei pazienti in cui sono troppo ridotti, e farmaci per i dolori, il vomito e la diarrea.
Per quanto concerne la prevenzione, innanzitutto è fondamentale che se viene accertato che un individuo è affetto, deve essere messo in isolamento per evitare la propagazione del virus. I medici e gli infermieri che si occupano di pazienti infetti, e i laboratoristi che maneggiano i campioni delle persone malate devono indossare dispositivi di protezione individuali adeguati (tute monouso, maschere, occhiali protettivi) e detergere le superfici contaminate con prodotti idonei come l’ipoclorito di sodio allo 0,5% o formalina al 10%. Lo stesso riguarda veterinari e allevatori che stanno a contatto con animali forse positivi a un virus, e macellai che manipolano la carne di animali potenzialmente infetti. Quando ci si trova in aree endemiche, bisogna evitare di ingerire cibo e acqua che potrebbero essere contaminati.
Non esistono dei vaccini contro i virus delle febbri emorragiche, ad eccezione dell’EVD, per il quale, nel maggio 2017, la Repubblica Democratica del Congo ha approvato rVSV-ZEBOV (Ervebo), un vaccino ricombinante formato dal virus della stomatite vescicolare (VSV), nel cui genoma è stato inserito il gene codificante per la glicoproteina di superficie dello Zaire ebolavirus (EBOV) (Fig. 10).

Anche per il LASV può esserci una speranza, dato che un gruppo di scienziati dell’Istituto Pasteur ha progettato due vaccini basati su virus vivi e attenuati, modificati per esprimere gli antigeni del LASV; parliamo di un ceppo ricombinante del virus del morbillo, che ha già fornito dei risultati soddisfacenti nei trial clinici per il virus chikungunya, e un Mopeia virus ricombinante, che è strettamente relazionato con il LASV ma non è patogeno per gli esseri umani. I ricercatori hanno confrontato l’efficacia di questi due vaccini sui modelli animali, e hanno dichiarato che sono ben tollerati e stimolano una protezione dopo una singola somministrazione, differendo nei livelli di efficacia. Quello che si è rivelato più conveniente è il morbillivirus esprimente le proteine del LASV, che è stato selezionato dal CEPI (Coalition for Epidemic Preparedness Innovations) per entrare nei test clinici sugli esseri umani.
Autore: Lorenzo Tramontana
Fonti
- https://www.msdmanuals.com/it-it/casa/infezioni/arbovirus-arenavirus-e-filovirus/panoramica-sulle-febbri-emorragiche
- https://www.cdc.gov/vhf/ebola/
- https://www.rainews.it/archivio-rainews/articoli/la-storia-del-virus-ebola-suora-belga-piot-microbiologo-9387ec5c-7ae1-43bb-9007-d30f2d4d0ee8.html?refresh_ce
- https://microbiologyinfo.com/structure-of-ebola-virus/
- https://www.salute.gov.it/imgs/C_17_pagineAree_3943_listaFile_itemName_0_file.pdf
- https://www.who.int/en/news-room/fact-sheets/detail/ebola-virus-disease
- https://healthy.thewom.it/salute/ebola/
- https://www.medicisenzafrontiere.it/cosa-facciamo/topic/ebola/
- Manasi Tamhankar, Dawn M. Gerhardt, Richard S. Bennett, Nicole Murphy, Peter B. Jahrling & Jean L. Patterson. 2018. “Heparan sulfate is an important mediator of Ebola virus infection in polarized epithelial cells”, Virology Journal
- Roosecelis Brasil Martines, Dianna L. Ng, Patricia W. Greer, Pierre E. Rollin and Sherif R. Zaki. 2015. “Tissue and cellular tropism, pathology and pathogenesis of Ebola and Marburg viruses”, Journal of Pathology
- https://www.epicentro.iss.it/marburg/
- Gianguglielmo Zehender, Chiara Sorrentino, Carla Veo, Lisa Fiaschi, Sonia Gioffrè, Erika Ebranati, Elisabetta Tanzi, Massimo Ciccozzi, Alessia Lai, Massimo Galli. 2016. “Distribution of Marburg virus in Africa: An evolutionary approach”, Infection, Genetics and Evolution
- Jonathan S. Towner, Xavier Pourrut, César G. Albariño, Chimène Nze Nkogue, Brian H. Bird, Gilda Grard, Thomas G. Ksiazek, Jean-Paul Gonzalez, Stuart T. Nichol, Eric M. Leroy. 2007. “Marburg Virus Infection Detected in a Common African Bat”, PLOS One
- https://www.msdmanuals.com/it-it/professionale/malattie-infettive/arbovirus-arenaviridae-e-filoviridae/infezioni-da-virus-di-marburg-ed-ebola
- https://www.bag.admin.ch/bag/it/home/krankheiten/krankheiten-im-ueberblick/marburg.html
- Mehedy Hasan Abir, Tanjilur Rahman, Ayan Das, Silvia Naznin Etu, Iqbal Hossain Nafiz, Ahmed Rakib, Saikat Mitra, Talha Bin Emran, Kuldeep Dhama, Ariful Islam, Abolghasem Siyadatpanah, Shafi Mahmud, Bonlgee Kim & Mohammad Mahmudul Hassan. 2022. “Pathogenicity and virulence of Marburg virus”, Virulence
- https://asm.org/Articles/2023/March/Marburg-Virus-Disease-Emergence-An-Update
- https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/filovirus
- https://www.sciencedirect.com/topics/immunology-and-microbiology/crimean-congo-hemorrhagic-fever-virus
- David W. Hawman & Heinz Feldmann. 2023. “Crimean–Congo haemorrhagic fever virus”, Nature reviews microbiology
- Marko Zivcec, Florine E. M. Scholte, Christina F. Spiropoulou, Jessica R. Spengler and Éric Bergeron. 2016. “Molecular Insights into Crimean-Congo Hemorrhagic Fever Virus”, Viruses
- https://www.epicentro.iss.it/congo-crimea/
- https://www.who.int/health-topics/crimean-congo-haemorrhagic-fever#tab=tab_1
- https://www.who.int/news-room/fact-sheets/detail/crimean-congo-haemorrhagic-fever
- https://www.cdc.gov/vhf/crimean-congo/index.html
- O. Ogbua, E. Ajuluchukwub & C. J. Uneke. 2007. “Lassa fever in West African sub-region: an overview”, J Vect Borne Dis
- Daniel R. Perez. 2017. “Plasmid-Based Reverse Genetics of Influenza A Virus”, Methods in Molecular Biology
- J Daniel Kelly, M Bailor Barrie, Rachel A Ross, Brian A Temple, Lina M Moses and Daniel G Bausch. 2013. “Housing equity for health equity: a rights-based approach to the control of Lassa fever in post-war Sierra Leone”, BMC International Health and Human Rights
- Idris Abdullahi Nasir and Fatima Muhammad Sani. 2015. “Outbreaks, Pathogen Containment and Laboratory Investigations of Lassa fever in Nigeria: How Prepared Are We?”, International Journal of Tropical Disease & Health
- Stefan Kunz, Jillian M. Rojek, Mar Perez, Christina F. Spiropoulou, and Michael B. A. Oldstone. 2005. “Characterization of the Interaction of Lassa Fever Virus with Its Cellular Receptor α-Dystroglycan”, Journal of Virology
- Junjie Shao, Yuying Liang, and Hinh Ly. 2015. “Human Hemorrhagic Fever Causing Arenaviruses: Molecular Mechanisms Contributing to Virus Virulence and Disease Pathogenesis”, Pathogens
- https://www.orpha.net/consor/cgi-bin/OC_Exp.php?lng=IT&Expert=99824
- https://www.salute.gov.it/portale/malattieInfettive/dettaglioSchedeMalattieInfettive.jsp?lingua=italiano&id=227&area=Malattie%20infettive&menu=indiceAZ&tab=1
- https://www.msdmanuals.com/it-it/professionale/malattie-infettive/arbovirus-arenaviridae-e-filoviridae/febbre-di-lassa
- https://www.izs.it/BENV_NEW/Engine/RAServePG.php/P/874710010500/M/309910040500/T/LASSA-FEVER-cosa-sta-succedendo-in-Nigeria
- https://www.cell.com/cell/fulltext/S0092-8674(15)00897-1
- https://www.nih.gov/news-events/news-releases/scientists-develop-novel-vaccine-lassa-fever-rabies
- https://www.cdc.gov/vhf/lassa/index.html
- https://www.viprbrc.org/brc/home.spg?decorator=arena_lassa
- https://www.pasteur.fr/en/research-journal/news/lassa-fever-vaccine-set-be-trialed
- https://www.bioprocessonline.com/doc/development-of-qualified-cold-chain-solution-for-vaccine-transport-to-uganda-0001/doc/development-of-qualified-cold-chain-solution-for-vaccine-transport-to-uganda-0001
- https://blog.deutsches-museum.de/2020/09/18/ebola-impfstoff
Ti è piaciuto l'articolo?
 BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
