Colture cellulari: differenza tra colture primarie e secondarie
🧫Le colture cellulari sono una delle tecniche più importanti sviluppate dalla biologia molecolare e cellulare per lo studio di una vasta gamma di processi biologici. Scopriamo la differenza tra colture primarie e secondarie, nel secondo episodio della rubrica! 🖋️ Autore: Umberto Lazzaro
Le colture cellulari sono state una delle tecniche più importanti sviluppate dalla biologia molecolare e cellulare per lo studio di una vasta gamma di processi biologici. L'immortalizzazione delle colture cellulari secondarie rappresenta una pietra miliare importante in questa disciplina.
Le colture cellulari primarie sono costituite da cellule prelevate direttamente da un organismo in vivo e coltivate in vitro in un terreno di coltura adeguato.
Esse sono ottenute a partire da diversi tessuti biologici, come il tessuto epiteliale, il tessuto muscolare, il tessuto nervoso, il tessuto osseo, il tessuto connettivo e organi mediante il processo di dissociazione dei tessuti in singole cellule.
Le colture cellulari primarie possono essere utilizzate per studiare i meccanismi molecolari delle malattie, per la valutazione della tossicità dei composti chimici e inoltre, possono essere utilizzate per valutare l'effetto di un farmaco su cellule sane e malate, al fine di identificare nuovi bersagli terapeutici e sviluppare farmaci più mirati e specifici.
Il prelievo delle cellule può avvenire tramite biopsia, prelievo chirurgico o prelievo post-mortem.
Le cellule così ottenute vengono coltivate in una soluzione nutritiva, il mezzo di coltura, che contiene sostanze nutritive essenziali come aminoacidi, vitamine, sali minerali e zuccheri, che sono i nutrienti necessari per la loro crescita e la loro sopravvivenza. Il terreno di coltura può contenere anche fattori di crescita, che stimolano la proliferazione e la differenziazione delle cellule.
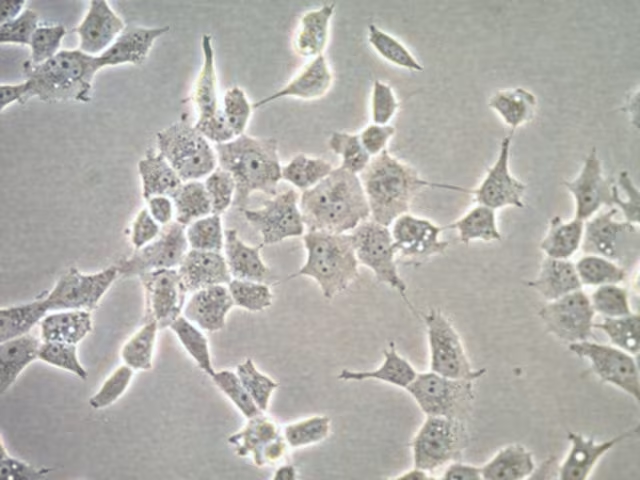
Le cellule primarie possono essere coltivate in vari tipi di ambiente di coltura, tra cui le piastre di coltura standard e i biorreatori. Inoltre, le cellule possono essere coltivate su supporti tridimensionali, come matrici di collagene o scaffolds polimerici, per simulare l'ambiente tridimensionale dei tessuti biologici.
Tuttavia, le colture cellulari primarie presentano alcune limitazioni. In primo luogo, le cellule in queste colture hanno un tempo di vita limitato, in quanto subiscono l'invecchiamento cellulare e muoiono dopo un certo numero di divisioni cellulari, da quì, la necessità della ricerca di creare uno strumento immortalizzato, le colture secondarie.
Le colture cellulari secondarie
Sono popolazioni di cellule derivate da una coltura cellulare primaria, ovvero una popolazione di cellule isolate dal tessuto biologico e coltivate in vitro. Dopo un certo numero di passaggi, ovvero la divisione cellulare e il trapianto in nuovi substrati di coltura, le colture cellulari primarie raggiungono un limite di replicazione e diventano inadatte per ulteriori studi.
Per superare questa limitazione, le colture cellulari primarie vengono sottoposte a un processo di subcoltura, in cui le cellule vengono separate dai substrati di coltura e divise in più flaconi e coltivate nuovamente in un ambiente controllato. Questo processo di subcoltura viene ripetuto più volte fino a raggiungere una popolazione cellulare omogenea, che viene chiamata coltura cellulare secondaria.
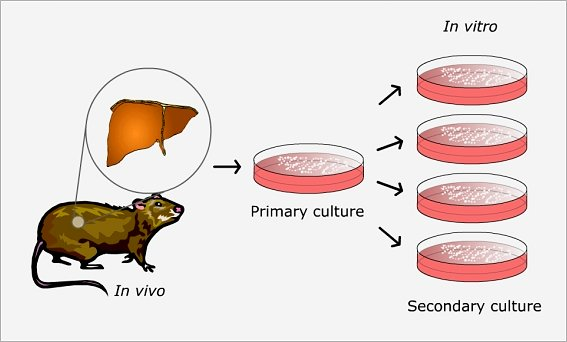
Le cellule sono in grado di replicarsi solo un numero limitato di volte prima di entrare in uno stato di senescenza. Questo limite è stato chiamato "limite di Hayflick" in onore del biologo Leonard Hayflick, che per primo ha descritto questo fenomeno negli anni '60.
L'immortalizzazione delle colture cellulari secondarie è il processo mediante il quale le cellule subiscono una mutazione genetica (trasformazione oncogena) che consente loro di continuare a replicarsi indefinitamente. In questo modo, le colture cellulari possono essere mantenute in vitro per periodi di tempo più lunghi rispetto alle colture cellulari primarie.
Un'altra differenza significativa tra le colture cellulari primarie e secondarie riguarda la loro stabilità genetica ed epigenetica. Le colture cellulari primarie tendono a subire modificazioni genetiche ed epigenetiche durante il processo di coltura, mentre le colture cellulari secondarie mantengono una maggiore stabilità delle caratteristiche genetiche e fisiologiche delle cellule del tessuto originale. Questo rende le colture cellulari secondarie un modello più affidabile e riproducibile.
L'immortalizzazione delle colture cellulari secondarie presenta numerosi vantaggi. In primo luogo, permette ai ricercatori di avere accesso a un numero praticamente illimitato di cellule per condurre gli esperimenti. Inoltre, possono essere congelate e conservate a lungo termine, consentendo ai ricercatori di eseguire esperimenti in momenti successivi senza dover ripetere l'immortalizzazione.
Tuttavia, ci sono anche dei rischi: le colture cellulari sono soggette alla contaminazione da agenti esterni come virus, batteri e funghi.
La contaminazione di colture cellulari può accadere in qualsiasi momento durante il processo di coltivazione, dal momento in cui si prelevano i campioni di tessuto fino alla fase finale di analisi dei dati.
La contaminazione di colture cellulari può portare a risultati imprecisi, compromettere la riproducibilità degli esperimenti e compromettere l'integrità dei dati raccolti. Inoltre, la contaminazione può influire sulle proprietà delle colture cellulari, alterando la loro morfologia, la crescita e il comportamento.
Principali fonti di contaminazione
Le principali fonti di contaminazione di colture cellulari sono rappresentate da agenti esterni come virus, batteri e funghi. Questi agenti possono essere introdotti in un laboratorio attraverso il personale, le forniture, o possono essere presenti nei campioni biologici prelevati per la coltura cellulare.
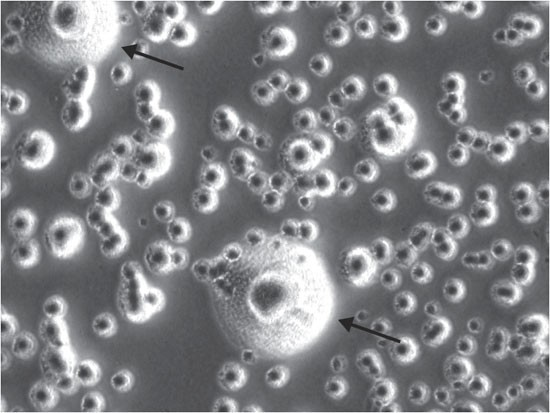
La contaminazione incrociata tra colture cellulari è un'altra fonte comune di contaminazione. Questo tipo di contaminazione si verifica quando le cellule di una coltura si diffondono in altre colture, compromettendo la purezza delle colture cellulari.
Modi per prevenire la contaminazione di colture cellulari
Esistono diversi modi per prevenire la contaminazione di colture cellulari. Uno dei modi più importanti è mantenere un'adeguata igiene e sicurezza nel laboratorio, che comprende la sterilizzazione di attrezzature e materiali utilizzati nella coltura cellulare, l'utilizzo di tecniche asettiche e l'uso di guanti e maschere protettive.
Un'altra misura importante per prevenire la contaminazione è la segregazione delle colture cellulari. Questo significa tenere le colture cellulari separate tra loro, utilizzare aree di lavoro dedicate per ogni coltura cellulare e utilizzare attrezzature e forniture specifiche per ogni coltura.
La verifica periodica delle colture cellulari è un altro modo importante per prevenire la contaminazione. Questo include l'esame regolare delle colture cellulari al microscopio per individuare eventuali anomalie nella morfologia delle cellule e l'esecuzione di test per la presenza di contaminanti.
🖋️ Autore: Umberto Lazzaro
Fonti
- Introduzione alle colture cellulari di G. Luigi Mariottini
- Arora, Meenakshi. "Cell culture media: a review." Mater methods 3.175 (2013): 24
- Hertz, L., B. H. J. Juurlink, and S. Szuchet. "Cell cultures." Neurochemical Systems (1985): 603-661
- Abbott, Alison. "Cell culture: biology's new dimension." Nature 424.6951 (2003): 870-873
- Langdon, Simon P. Cancer cell culture. Vol. 5. No. 9. umana, 2010
Ti è piaciuto l'articolo?
 BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.