Pesce crudo: cibo molto salutare, ma attenzione ai parassiti!
🐟Nonostante le peculiarità salutari, ingerire pesce crudo comporta il rischio di diverse patologie che possono rivelarsi dannose, tra cui le parassitosi. Capiamone di più!

Introduzione
Quando parliamo di pesce crudo, ci riferiamo a un alimento che per molto tempo è stato considerato pregiato e costoso, e la sua consumazione raffigura, al giorno d’oggi, un’abitudine alimentare diffusa ormai in ogni parte del mondo. Mentre in oriente l’usanza di mangiare pesce crudo è ben radicata, in occidente, fino a qualche tempo fa, è rimasto un privilegio di un numero ristretto di persone. La diffusione di sushi e sashimi al di fuori dei paesi dell’est ha consentito di trovare facilmente piatti a base di pesce crudo in vari ristoranti, a prezzi accessibili.
L’inserimento del pesce crudo nella dieta ha molteplici vantaggi, dal momento che le numerose proprietà nutrizionali che contiene (tra cui le proteine, le vitamine, i sali minerali come il fosforo, lo iodio, il potassio e il ferro, e gli acidi grassi essenziali come l’Omega 3) non vengono alterate o distrutte dalle alte temperature tipiche della cottura. Tra i vari benefici ricordiamo per esempio il controllo del colesterolo cattivo grazie agli acidi grassi polinsaturi, e il funzionamento corretto degli apparati digerente, circolatorio e nervoso grazie alle vitamine del gruppo B.
Nonostante le peculiarità salutari, ingerire pesce crudo comporta il rischio di diverse patologie che possono rivelarsi dannose, tra cui le parassitosi, cioè le infezioni da parassiti, la cui frequenza si concentra soprattutto nei paesi in cui è più popolare l’abitudine di preparare piatti a base di pesce crudo, ovvero Giappone (sushi e sashimi), Scandinavia (fegato di merluzzo), Olanda (aringhe fermentate), Bacino del Mediterraneo (acciughe marinate), Filippine (Bagoong, salsa di pesce fermentato), Hawaii (Lomi-lomi, insalata di pomodoro e salmone) e costa pacifica dell’America meridionale (Ceviche, insalata di pesce e frutti di mare marinati e speziati) (Fig. 1).
In questo articolo ci focalizzeremo su quattro vermi parassiti che facilmente risiedono in svariati animali acquatici, ovvero Anisakidae, Clonorchis sinensis, Paragonimus spp. e Diphyllobothrium (latum e dendriticum).

Anisakidae
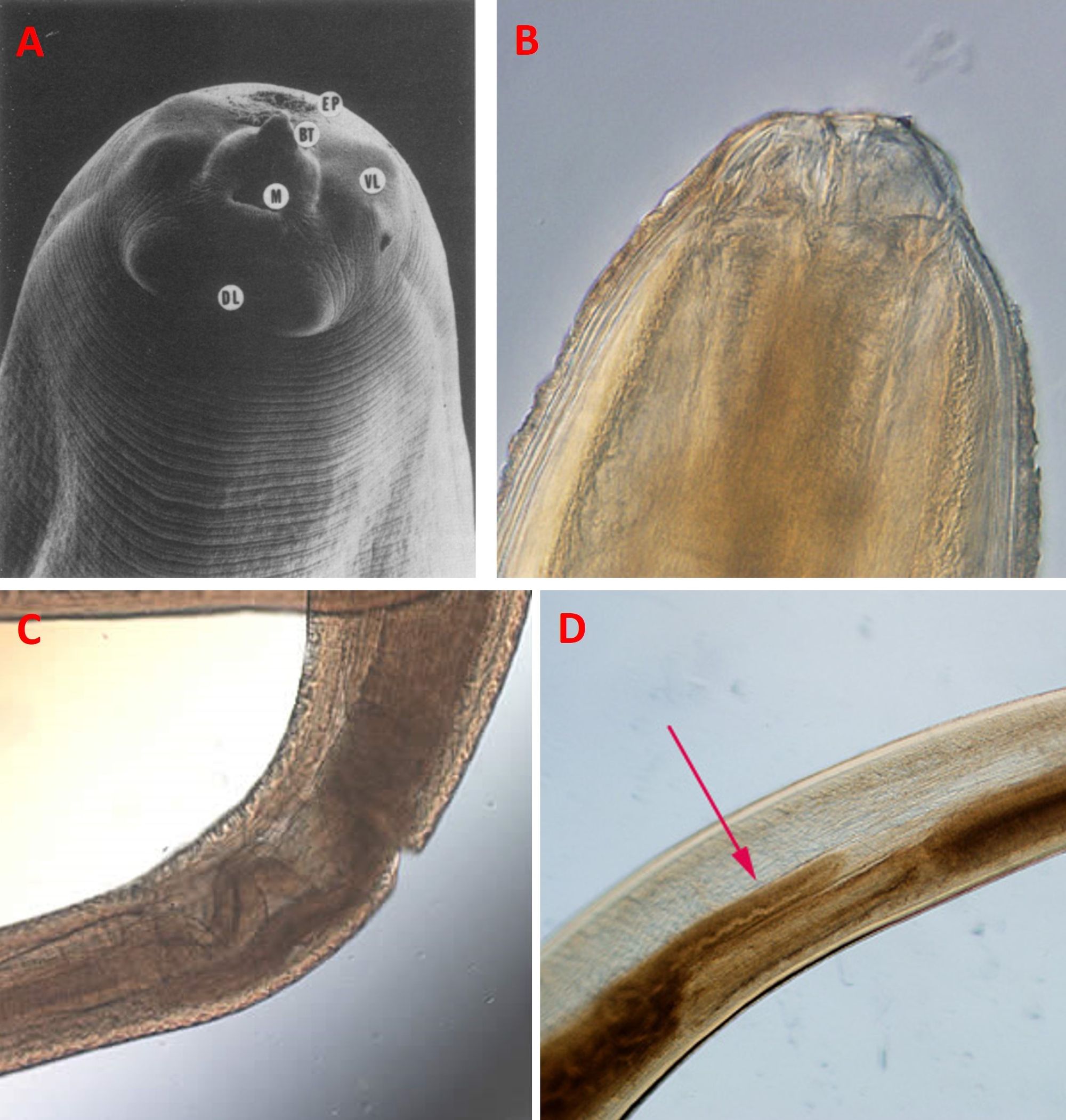
Il nome Anisakidae indica una famiglia di vermi appartenenti al phylum dei Nematodi, ossia i vermi cilindrici, che comprende i generi Anisakis, Pseudoterranova e Contracaecum, responsabili della malattia denominata anisakiasi o anisakidosi. Questi vermi hanno una lunghezza che va da 10 a 29 mm (Anisakis) o da 25 a 50 mm (Pseudoterranova), sono rivestiti da una cuticola esterna che viene sostituita nei diversi stadi della crescita, e presentano un’apertura orale, tre labbra bilobate, una dorsale e due ventrali, un dente perforante, un poro escretore, e un tubo digestivo semplice formato da esofago, ventricolo e intestino (in Pseudoterranova c’è anche il cieco rivolto anteriormente) (Fig. 2). Dal punto di vista sessuale, il maschio possiede delle strutture simili a lancette (le spicole copulatorie), che servono per dilatare la vulva della femmina durante l’accoppiamento e facilitare l’iniezione dello sperma.
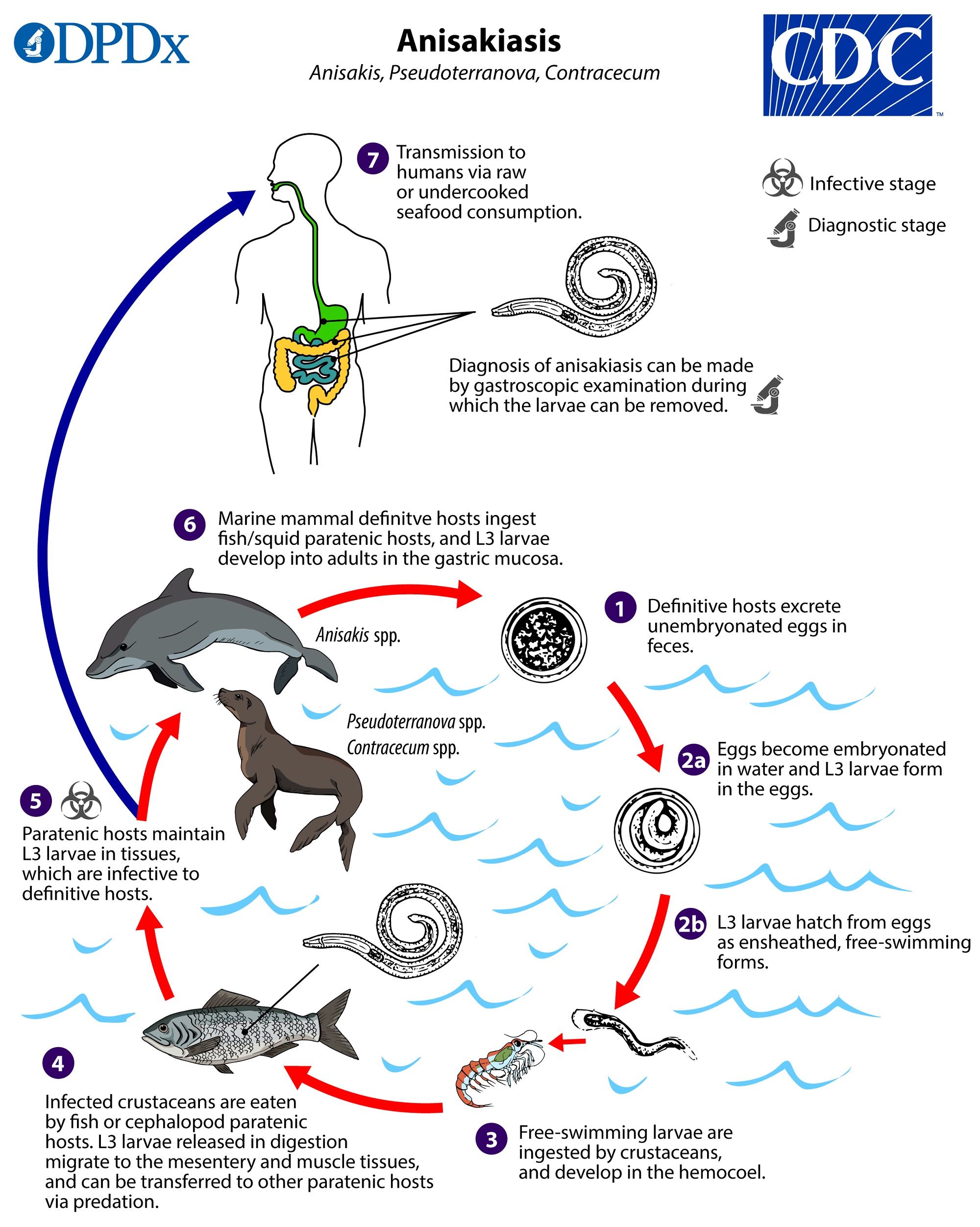
Il ciclo vitale (Fig. 3) di questi parassiti inizia nel momento in cui i vermi adulti, che risiedono nello stomaco e nell’intestino di mammiferi di mare come delfini, balene e pinnipedi, si accoppiano e depongono le uova non embrionate (non contenenti l’embrione), che sono eliminate con le feci. Nell’ambiente acquatico all’interno delle uova si genera l’embrione (uova embrionate), che in seguito si trasforma in larva, la quale attraversa le prime tre fasi di sviluppo (L1, L2 e L3) ed esce dall’uovo. Le larve libere nell’acqua vengono poi ingerite dai crostacei planctonici, dove raggiungono l’emocele (il sistema circolatorio), proseguono la loro crescita e diventano infettive per i prossimi predatori, ovvero pesci e molluschi; in questi ultimi, una volta arrivate all’intestino, le larve penetrano nella cavità addominale, si diffondono nei tessuti mesenterici e nei muscoli scheletrici. In caso di predazione da parte dei mammiferi marini, che sono gli ospiti definitivi, le larve passeranno al quarto stadio (L4) e infine diventeranno vermi adulti. Se invece le larve L3 vengono inghiottite dall’essere umano, non completano il loro ciclo biologico e vanno incontro a tre destini differenti: 1) Si collocano nell’orofaringe o nell’esofago, la persona sente una sensazione di pizzicore alla gola, tossisce e generalmente espelle i vermi; 2) Giungono nello stomaco, sono attaccate dai succhi gastrici e muoiono senza provocare alcun disturbo; 3) Invadono la mucosa gastrica e/o intestinale, determinando la cosiddetta sindrome da larva migrans viscerale o anisakidosi gastrointestinale. Tale patologia è distinta dai seguenti sintomi: nausea, vomito, dolori epigastrici, dolori addominali, febbre, eosinofilia (aumento dei granulociti eosinofili) e diarrea. Può succedere che le larve rimangono bloccate nelle mucose, stimolano una reazione granulomatosa e muoiono, oppure perforano le pareti degli organi con conseguenti emorragie; raramente si localizzano nella cavità addominale, e a volte possono indurre reazioni allergiche come orticaria, congiuntivite e shock anafilattico.
I pesci che maggiormente rappresentano un rischio elevato di anisakiasi sono il salmone, il tonno, lo sgombro, la ricciola, il pesce spada, il pesce sciabola, la lampuga, il merluzzo, il tombarello, il nasello, la sardina, l’acciuga, la rana pescatrice e l’aringa. Quando si manipolano i pesci infetti, le larve allo stadio L3 sono osservabili ad occhio nudo nella cavità addominale, nell’intestino, nel fegato e nei muscoli. Due caratteristiche evidenti sono il colore bianco, rosato o scuro e la tendenza ad arrotolarsi a spirale (Fig. 4).
Paragonimus spp. e Clonorchis sinensis
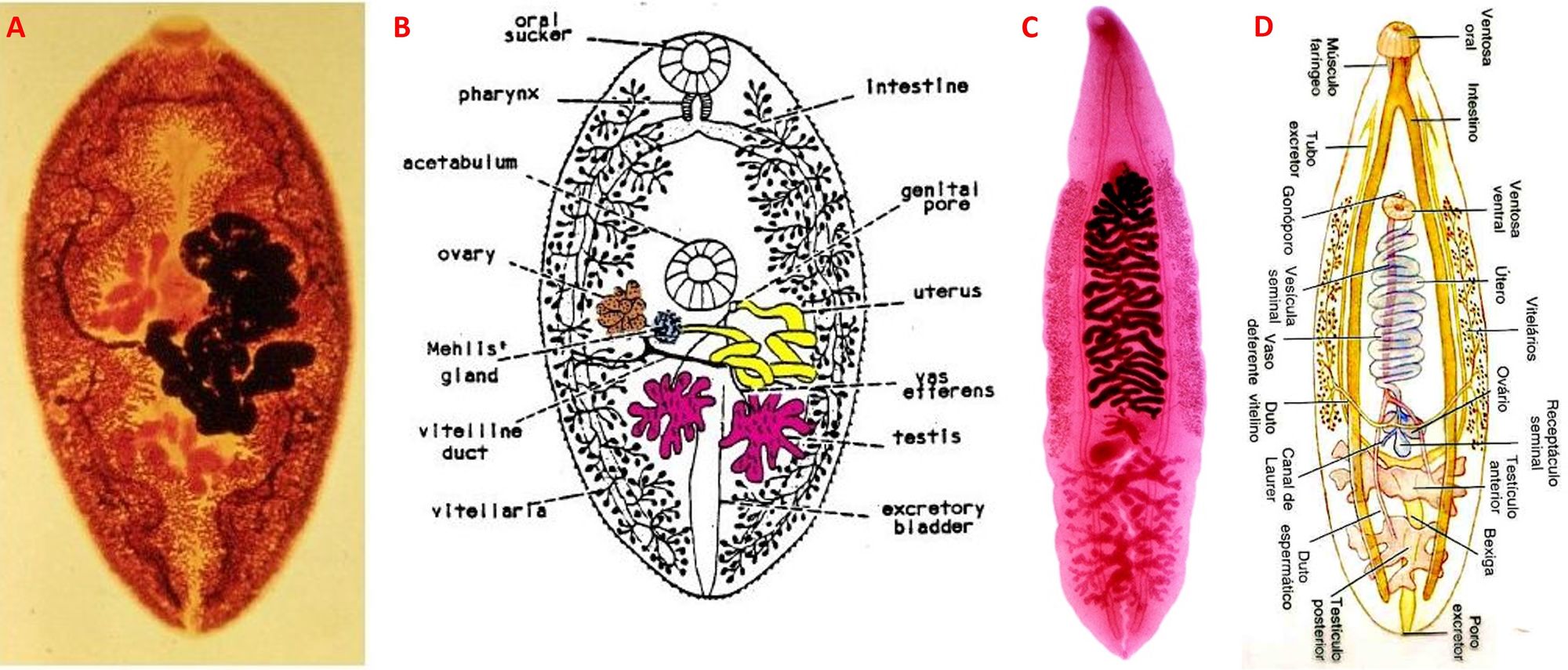
Paragonimus spp. (westermani è il più comune) e C. sinensis (conosciuto anche come Opistorchis sinensis, verme epatico cinese e verme epatico orientale) sono due platelminti (vermi piatti) che rientrano nella classe dei Trematodi e nella sottoclasse dei Digenei, termine che indica la presenza di due tipi di riproduzione, ovvero sessuata nello stadio adulto e asessuata in quello larvale. Dal punto di vista morfologico i vermi adulti sono contraddistinti da un corpo appiattito la cui forma ricorda una foglia (C. sinensis) o un chicco di caffè (Paragonimus), due ventose che fungono da organi di adesione (una che circonda l’apertura orale e una collegata all’apparato riproduttore), un intestino biforcato e a fondo cieco. I sistemi nervoso, escretore e digerente sono primitivi, mentre gli apparati circolatorio e respiratorio sono assenti. A livello sessuale sono ermafroditi, posseggono l’ovaio, due testicoli divisi in lobuli, l’utero e i dotti spermatici; questi ultimi due organi si aprono sul poro genitale. I lati del corpo sono colmi di ghiandole ramificate dette ghiandole vitelline o vitellaria (Fig. 5). Le dimensioni sono 15-20 mm di lunghezza e 3-4 mm di larghezza per O. sinensis, mentre Paragonimus è lungo da 7 a 16 mm e largo da 4 a 8 mm.
Questi platelminti raffigurano gli agenti patogeni di due malattie, cioè la paragonimiasi, che coinvolge i polmoni, e la clonorchiasi, che colpisce il fegato, e il loro ciclo biologico (Fig. 6) inizia quando il verme adulto depone le uova nell’ospite definitivo, che le espelle mediante le feci (C. sinensis) o con l’escreato (Paragonimus). Nel caso di Paragonimus, quando le uova vengono liberate in acqua dolce, si dischiudono e rilasciano il miracidio (il primo stadio larvale), il quale penetra nel primo ospite intermedio, cioè un mollusco gasteropode (chiocciola), mentre nel caso di O. sinensis, il miracidio fuoriesce quando l’uovo viene ingerito dal mollusco. All’interno del primo ospite il miracidio va incontro a riproduzione asessuata e attraversa tre fasi, che sono sporociste, redia e cercaria. A questo punto le cercarie, dotate di una coda biforcuta importante per la locomozione, abbandonano la chiocciola ed entrano nel secondo ospite intermedio, ossia i pesci d'acqua dolce come salmonidi e ciprini (C. sinensis) o i crostacei come granchi o gamberi d’acqua dolce (Paragonimus). In questi organismi le larve si incistano e si convertono in metacercarie, dalla forma sferoidale. Se il pesce o il crostaceo infetti vengono mangiati dai mammiferi come felidi, canidi, suini, roditori, scimmie ed essere umano, gli enzimi digestivi eliminano la parete cistica che circonda le metacercarie, e tale processo si verifica nel duodeno. Le metacercarie, nel caso di O. sinensis, si muovono in senso contrario fino ad addentrarsi nelle vie biliari, mentre nel caso di Paragonimus, trapassano la parete intestinale, accedono alla cavità peritoneale e, dopo aver perforato il diaframma, si spingono nelle cavità pleuriche e infine nei polmoni. In queste sedi avviene lo sviluppo dei vermi adulti e la conseguente emissione delle uova che, una volta espulse all’esterno, consentiranno la ripetizione del ciclo.
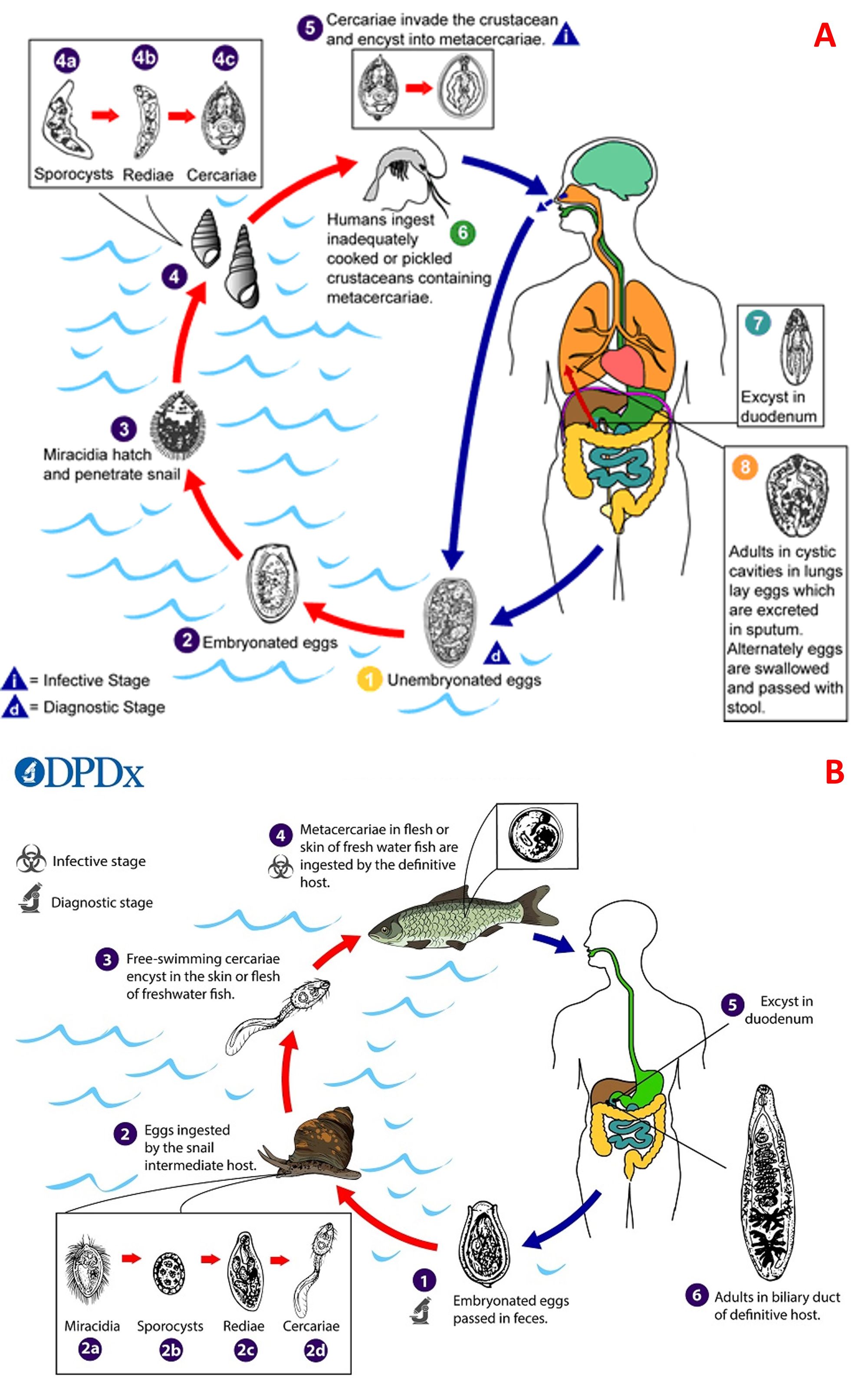
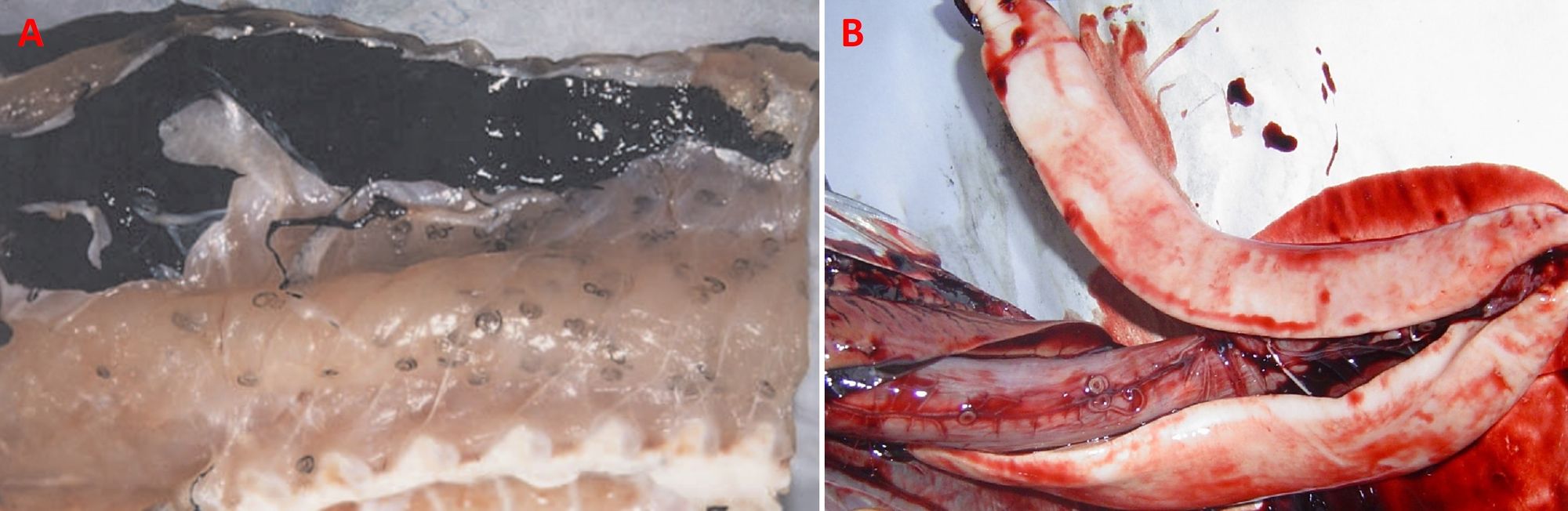
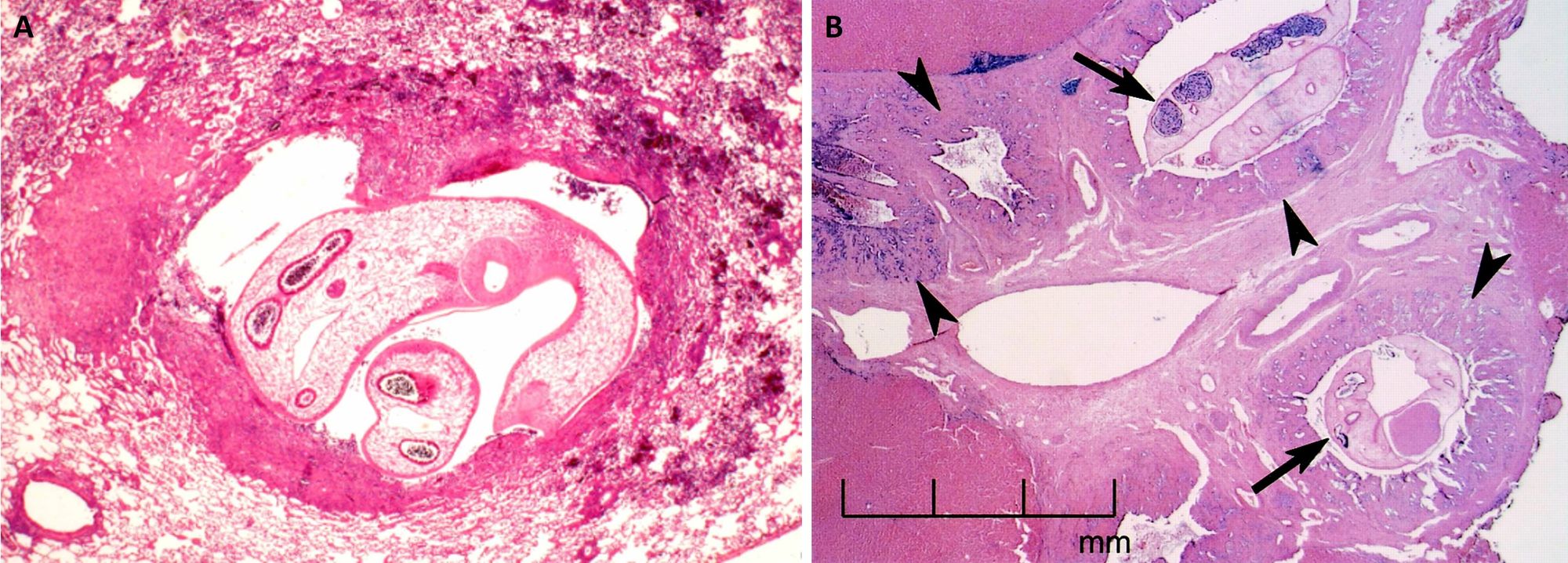
I vermi adulti di Paragonimus, presenti nei polmoni, risiedono in una capsula fibrosa la cui formazione è legata a una reazione tissutale prima granulomatosa e successivamente fibrotica; tale capsula si riempie di un liquido puruloide brunastro che si riversa in un bronchiolo (Fig. 7A). Il periodo di permanenza dei parassiti può arrivare fino a vent’anni. Per quanto concerne O. sinensis, i vermi adulti, che possono permanere fino a 10-12 anni, impiegano come fonte di nutrimento l’epitelio biliare, causando dilatazione dei dotti, iperplasia dell’epitelio e fibrosi periduttale (Fig. 7B). In caso di infezione cronica, si può arrivare a infiammazione dei dotti biliare (colangite), cirrosi epatica, colangiocarcinoma (tumore maligno dei dotti biliari) ed epatocarcinoma.
Descriviamo ora i sintomi delle due patologie. La paragonimiasi acuta è caratterizzata da febbricola, tosse spasmodica, malessere generale, emottisi, orticaria, splenomegalia, eosinofilia, diarrea, dolori addominali, dolori toracici spesso collegati a broncopolmonite, pleurite e pneumotorace. Quando si passa alla fase cronica, che combacia col momento in cui gli addensamenti dove albergano i vermi adulti si riducono di dimensioni e diventano piccole lesioni cistiche, insorgono tosse secca con espulsione di uno sputo giallo-brunastro (dovuto al liquido presente nella capsula), dolore toracico e dispnea.
Per quanto concerne la clonorchiasi, normalmente è asintomatica o con manifestazioni aspecifiche come dolore addominale, diarrea e nausea. In situazioni in cui il numero di parassiti è elevato, invece, le conseguenze possono essere blocco del flusso biliare, che conduce a colestasi, ittero ostruttivo e malassorbimento di lipidi, ferro e vitamine liposolubili. La mancata assimilazione di questi tre nutrienti provoca calo ponderale, anemia, spossatezza, diarrea cronica e steatorrea (grassi nelle feci).
Diphyllobothrium
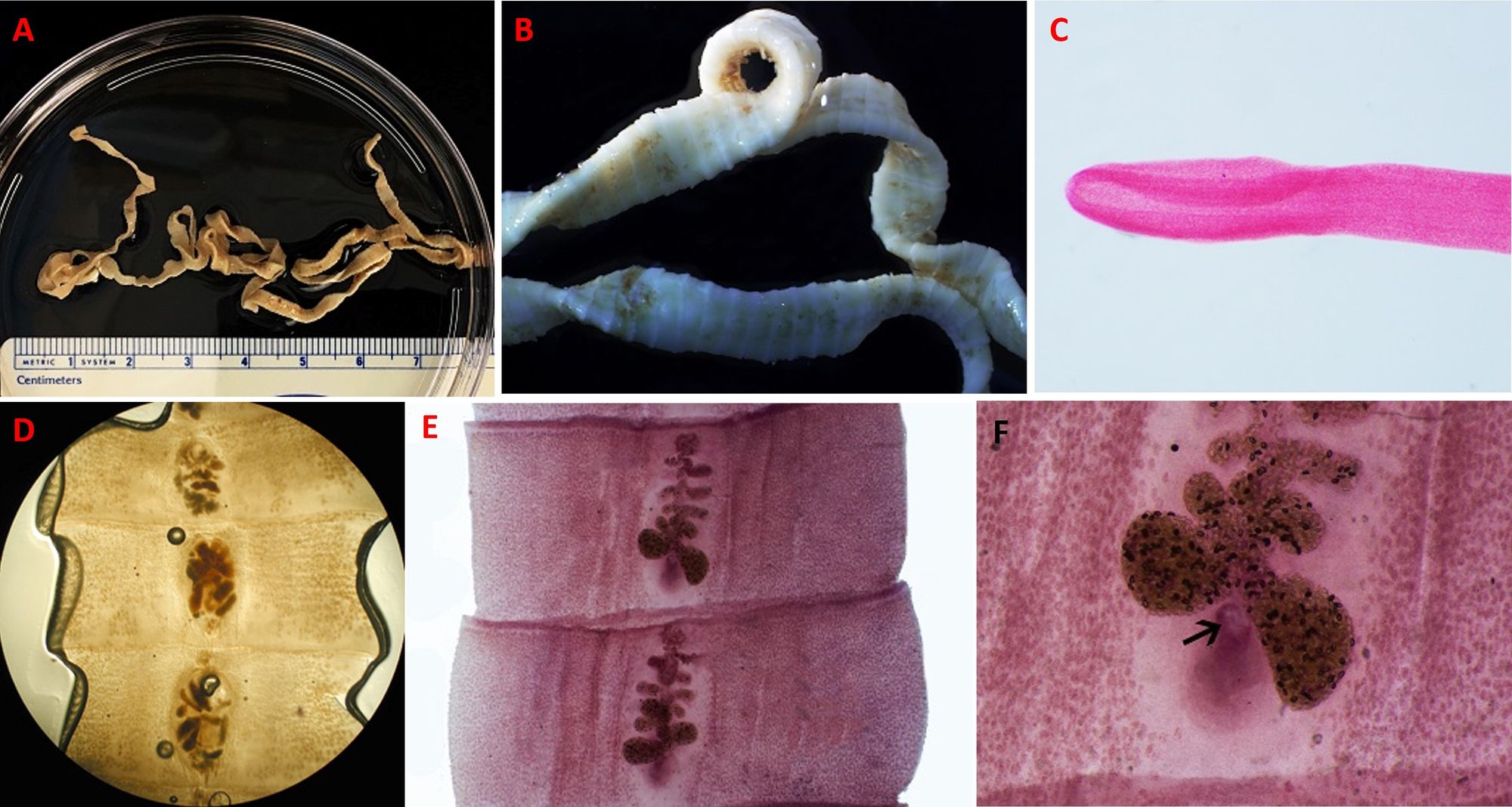
Denominato anche “tenia dei pesci”, Diphyllobothrium è un platelminta che si colloca nella classe dei Cestodi e nell’ordine degli Pseudofillidei, cioè vermi che, al pari dei Digenei, compiono una parte del loro ciclo in acqua. Rappresenta il verme parassita umano più lungo, infatti arriva a misurare dai 4 ai 15 metri, ma all’interno dell’intestino può raggiungere i 25 metri. Morfologicamente è contraddistinto da tre componenti: lo scolice (la parte anteriore), in cui sono presenti delle fossette prensili dette botridi, che servono per aderire alla mucosa intestinale, il collo, la zona tubulare e intermedia, e lo strobilo, ossia la catena di segmenti (proglottidi) aventi origine dal collo e contenenti gli organi riproduttivi sia maschili che femminili, che generano le uova. Ogni proglottide possiede il poro uterino e il poro genitale sulla superficie medio-ventrale, i testicoli distribuiti lateralmente, l’ovaio bilobato e l’utero a rosetta collocati più al centro (Fig. 8); le proglottidi più lontane dal collo sono quelle più mature.
Diphyllobothrium compie il suo ciclo vitale (Fig. 9) in questo modo: gli ospiti definitivi eliminano tramite le feci le uova non embrionate che, quando si trovano in acqua dolce e in condizioni ambientali favorevoli (temperatura tra 16 e 20° C), maturano nel giro di circa 8-12 giorni e all’interno di esse si forma l’embrione, chiamato oncosfera o larva esacanta. Dopodiché, si schiudono e rilasciano il coracidio (primo stadio larvale); quest’ultimo viene ingerito dai piccoli crostacei dei generi Cyclops o Diaptomus, e si sviluppa in procercoide nelle cavità. Quando i pesci come il salmone, il pesce persico, il luccio, l’anguilla e il coregone mangiano il crostaceo, il verme si converte in plerocercoide (stadio infettivo), che si incista nei muscoli o nelle viscere del predatore. In seguito all’ingestione di pesci infetti da parte degli ospiti finali (essere umano, orsi, canidi, felidi e mustelidi), la larva passa allo stadio di verme adulto nell’intestino tenue, si attacca all’epitelio, assorbe i nutrienti attraverso il tegumento dotato di microvilli e cresce aumentando il numero di proglottidi; queste scaricano le uova immature che vengono espulse tramite le feci. La comparsa delle uova negli escrementi avviene cinque o sei settimane dall’infezione.
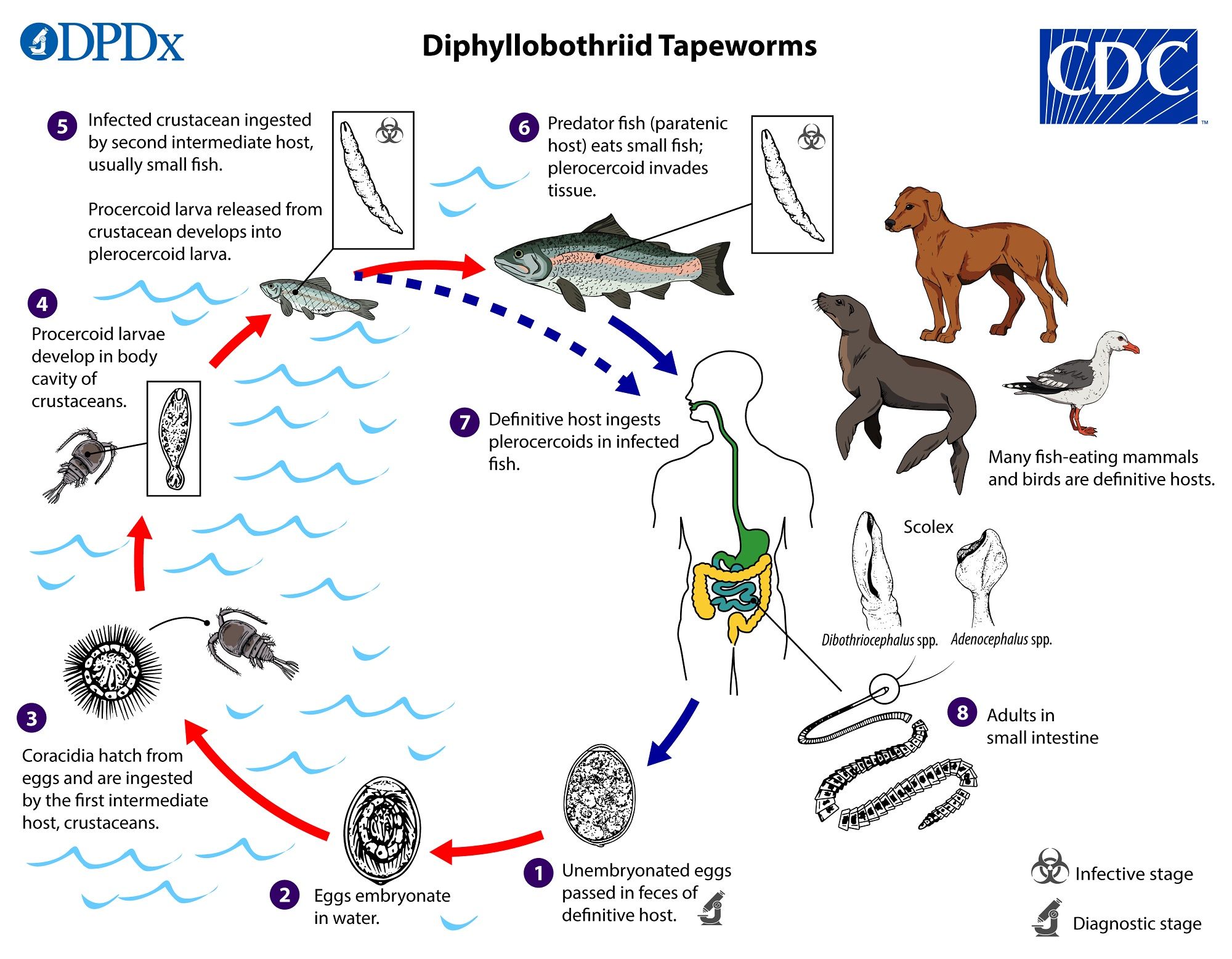
Nell’intestino degli ospiti definitivi Diphyllobothrium determina dei cambiamenti strutturali e altera il funzionamento del tratto gastrointestinale modulando la risposta neuroendocrina, con conseguente incremento della secrezione ormonale e della motilità intestinale. Il danno causato dal parassita è mediato anche dal reclutamento di cellule immunitarie come mastociti ed eosinofili, che rilasciano citochine pro-infiammatorie. In aggiunta a ciò, il verme sottrae la vitamina B12, conducendo a una condizione di anemia perniciosa. I sintomi primari della malattia, chiamata difillobotriasi, sono diarrea, perdita di peso e malessere addominale. In gran parte dei casi, però, l’infezione è asintomatica.
Diagnosi
L’approccio per diagnosticare le infezioni da vermi parassiti consiste nell’anamnesi e nell’indagine sull’alimentazione dei pazienti per poter collegare i sintomi all’ingestione di determinati cibi, in questo caso pesce crudo o poco cotto. Questa fase è fondamentale dal momento che i sintomi sono aspecifici e possono essere confusi con altre patologie: per esempio la paragonimiasi può essere scambiata per la tubercolosi, l’anisakidosi per l’ulcera, l’ostruzione intestinale o il morbo di Chron. In seguito, si passa alle analisi di laboratorio, nelle quali è spesso incluso l’esame microscopico di uno specifico campione al fine di ricercare le uova o le larve. In altre circostanze, invece, si ricorre a metodiche diverse, come nel caso dell’anisakiasi, la cui diagnosi prevede l’endoscopia del tratto superiore dell’intestino, che permette di avvistare le larve incastrate nelle mucose. Se l’individuo espelle le larve con la tosse, può usarle come campione da analizzare.
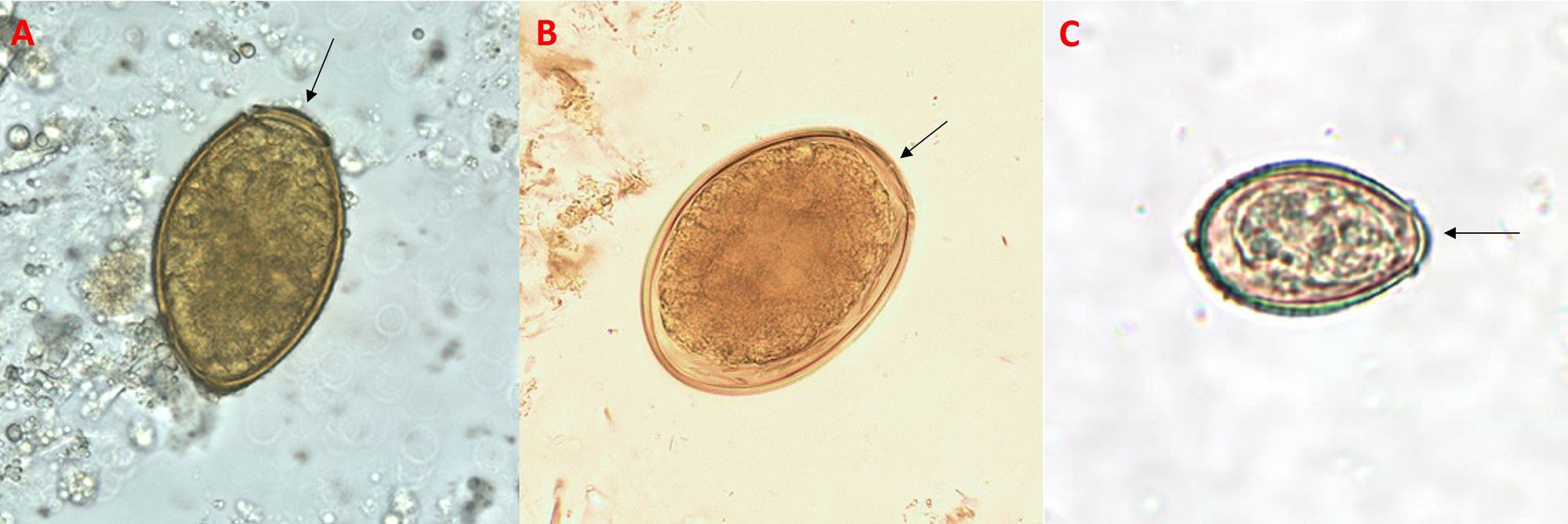
La clonorchiasi e la difillobotriasi si diagnosticano tramite l’osservazione microscopica delle feci, mentre per la paragonimiasi tale analisi si effettua anche sull’espettorato, dal momento che le uova vengono facilmente emesse tossendo; se invece dall’ipofaringe vanno nell’esofago, si troveranno nelle feci (l’esame copro-parassitologico si applica in particolare ai bambini, dal momento che ingoiano le uova del parassita più frequentemente). L’indagine al microscopio si basa sulla valutazione delle caratteristiche delle uova, che appaiono ovoidali, marroncine e opercolate (dotate di opercolo, l’organo mobile che sigilla l’apertura da cui esce l’embrione) (Fig. 10). Tuttavia, questa procedura può avere una bassa sensibilità e non riuscire a identificare con precisione l'agente patogeno, ragion per cui si adoperano anche ulteriori metodiche. Nel caso della difillobotriasi, si eseguono delle analisi sul sangue allo scopo di rilevare una potenziale anemia perniciosa, come l'emocromo e il dosaggio della vitamina B12; per la paragonimiasi si effettua il dosaggio anticorpale mediante ELISA (saggio immuno-assorbente legato ad un enzima) e/o la tomografia computerizzata del polmone, che permette di rimarcare le formazioni cistiche, le strie opache collegate alla pleura (che coincidono con i percorsi dei vermi), i versamenti e gli ispessimenti pleurici; per la clonorchiasi una tecnica idonea è la radiologia, attraverso cui si evidenziano dilatazione uniforme e diffusa dei dotti biliari intraepatici periferici (correlata con la presenza dei vermi), con o senza una leggera dilatazione dei dotti extraepatici, e anomalie dei dotti in cui la normale opacizzazione del lume è alterata.
Terapia e profilassi
Per curare la paragonimiasi, la clonorchiasi e la difillibotriasi, il farmaco maggiormente adoperato è il Praziquantel (Biltricide), che si somministra per via orale e agisce inducendo la paralisi muscolare e alterando la morfologia del parassita. In più promuove la vacuolizzazione e la disintegrazione del tegumento del verme. Questo farmaco si può assumere in gravidanza, ma è sconsigliato durante l’allattamento, poiché compare nel latte materno. Inoltre, è controindicato negli individui che hanno mostrato ipersensibilità in precedenza.
Per l’anisakidosi la terapia migliore è la rimozione delle larve durante l’endoscopia, quando è possibile, altrimenti, in caso di ostruzione intestinale, è richiesto un intervento chirurgico. Può essere efficace, anche se in maniera limitata, l’uso del farmaco Albendazolo (Zentel), che blocca la divisione cellulare del parassita impedendo l’assemblaggio della tubulina, e interferisce con la captazione del glucosio.
La profilassi consiste specialmente nel cuocere correttamente il pesce a una temperatura maggiore di 63° C, oppure, se lo si vuole mangiare crudo, congelarlo a -20° C per sette giorni o a -35° C per almeno 15 ore.
Lorenzo Tramontana
Fonti
- https://www.nutridoc.it/articoli/pesce-crudo
- https://www.angsarap.net/2021/03/24/ginisang-bagoong/
- https://www.cookedandloved.com/recipes/lomi-lomi-salmon-avocado-salad/
- https://www.bowlofdelicious.com/shrimp-ceviche/
- https://www.ilgiornaledelcibo.it/differenza-tra-sushi-e-sashimi-curiosita/
- https://www.issalute.it/index.php/la-salute-dalla-a-alla-z-menu/a/anisakidosi-o-anisakiasi
- https://www.cdc.gov/dpdx/anisakiasis/index.html
- https://www.msdmanuals.com/it-it/professionale/malattie-infettive/nematodi-ascaridi/anisakiasi
- https://spvet.it/arretrati/numero-70/001Spvet70.html
- Gabriella Cancrini. 2013. “Parassitologia e tecniche di laboratorio”, Lombardo Editore
- Judy A. Sakanari and James H. McKerrow. 1989. “Anisakiasis”, Clinical Microbiology Reviews
- Amato Neto V, Amato JG, Amato VS. 2007. “Probable recognition of human anisakiasis in Brazil”, Rev. Inst. Med. Trop. Sao Paulo
- M. Teresa Audicana and Malcolm W. Kennedy. 2008. “Anisakis simplex: from Obscure Infectious Worm to Inducer of Immune Hypersensitivity”, Clinical Microbiology Reviews
- Qian Men-Bao, Utzinger Jürg, Keiser Jennifer and Zhou Xiao-Nong. 2016. "Clonorchiasis", The Lancet
- Sripa Banchob, Tesana Smarn, Yurlova Natalia and Nawa Yukifumi. 2017. "A historical review of small liver fluke infections in humans", Parasitology International
- Yoshida Yukio. 2012. "Clonorchiasis—A historical review of contributions of Japanese parasitologists", Parasitology International
- Hong ST and Fang Y. 2012. “Clonorchis sinensis and clonorchiasis, an update”, Parasitology International
- Byung Ihn Choi, Joon Koo Han, Sung Tae Hong and Kyoung Ho Lee. 2004. “Clonorchiasis and Cholangiocarcinoma: Etiologic Relationship and Imaging Diagnosis”, Clinical Microbiology Reviews
- https://www.cdc.gov/dpdx/clonorchiasis/index.html
- https://www.ncbi.nlm.nih.gov/books/NBK304354/
- http://mt-lectures.blogspot.com/2016/07/lecture-8-liver-flukes.html
- https://www.cdc.gov/dpdx/paragonimiasis/index.html
- https://www.cdc.gov/parasites/paragonimus/
- https://crocodilusdaratensis.wordpress.com/2010/08/17/paragonimus-westermani/
- Desowitz, R. 1987. “New Guinea Tapeworms and Jewish Grandmothers: Tales of Parasites and People”
- Francis E. G. Cox. 1996. “The wellcome trust illustrated history of tropical diseases”, The Wellcome Trust, London, United Kingdom
- Philip E. S. Palmer, Maurice M Reeder, 2001. “The Imaging of Tropical Diseases: with epidemiological, pathological and clinical correlation”, Springer Verlag
- J.P. Dubey. 2023. “Paragonimus kellicotti infections in animals and humans in USA and Canada: Review and personal perspective”, Food and Waterborne Parasitology
- https://www.merckmanuals.com/professional/infectious-diseases/trematodes-flukes/paragonimiasis
- https://www.askjpc.org/vspo/show_page.php?id=RTFVNEh0Y3VNT1NHL1NsZ0pJd1VYZz09
- https://www.cdc.gov/dpdx/diphyllobothriasis/index.html
- https://www.cdc.gov/parasites/diphyllobothrium/biology.html
- https://www.msdmanuals.com/professional/infectious-diseases/cestodes-tapeworms/diphyllobothriasis-fish-tapeworm-infection
- https://www.ncbi.nlm.nih.gov/books/NBK540971/
- April 2012. “Diphyllobothrium latum”, ANSES (French agency for food, environmental and occupational health & safety)
- Ibrahim S. Alkhalife, Rafiaa R. Hassan, Ahmed A. Abdel-Hameed, Laila A. Al-Khayal. 2006. “Diphyllobothriasis in Saudi Arabia”, Saudi Medical Journey
- https://www.accessdata.fda.gov/drugsatfda_docs/label/2014/018714s013lbl.pdf
Ti è piaciuto l'articolo?
 BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
