Candida auris - Il fungo killer incubo di medici e pazienti
🔬 Candida auris costituisce un pericolo per la salute globale, ed è considerata l’incubo sia del personale medico-sanitario che dei pazienti. Il motivo risiede in molteplici caratteristiche. Scopriamola insieme in questo nuovo articolo!
Introduzione
Candida auris è un fungo lievitiforme appartenente al phylum degli Ascomiceti, il cui nome della specie deriva dal latino “orecchio”, e indica il sito in cui tale microorganismo è stato identificato, nel 2009, in una donna giapponese di 70 anni ricoverata presso il Tokyo Metropolitan Geriatric Hospital. I medici fecero un tampone del canale auricolare esterno, su cui venne effettuata l’analisi colturale su CHROMagar Candida e il saggio molecolare su specifiche sequenze del DNA estratto, ovvero le regioni ITS (internal transcribed spacer) e il dominio D1/D2 della subunità 26S del DNA ribosomale. Gli studi tassonomici indicarono l’esistenza di una nuova specie avente una relazione filogenetica con Candida ruelliae e Candida haemulonii. Nonostante il nuovo ceppo proliferasse bene a 40° C, mostrava una crescita debole e lenta a 42° C. Da qui fu proposta la descrizione tassonomica C. auris.
È rilevante sottolineare che la vicenda appena descritta non rappresenta il primo isolamento del micete, poiché già nel 1996 la letteratura scientifica ne riportò la presenza in una serie di campioni provenienti dalla Corea del Sud.
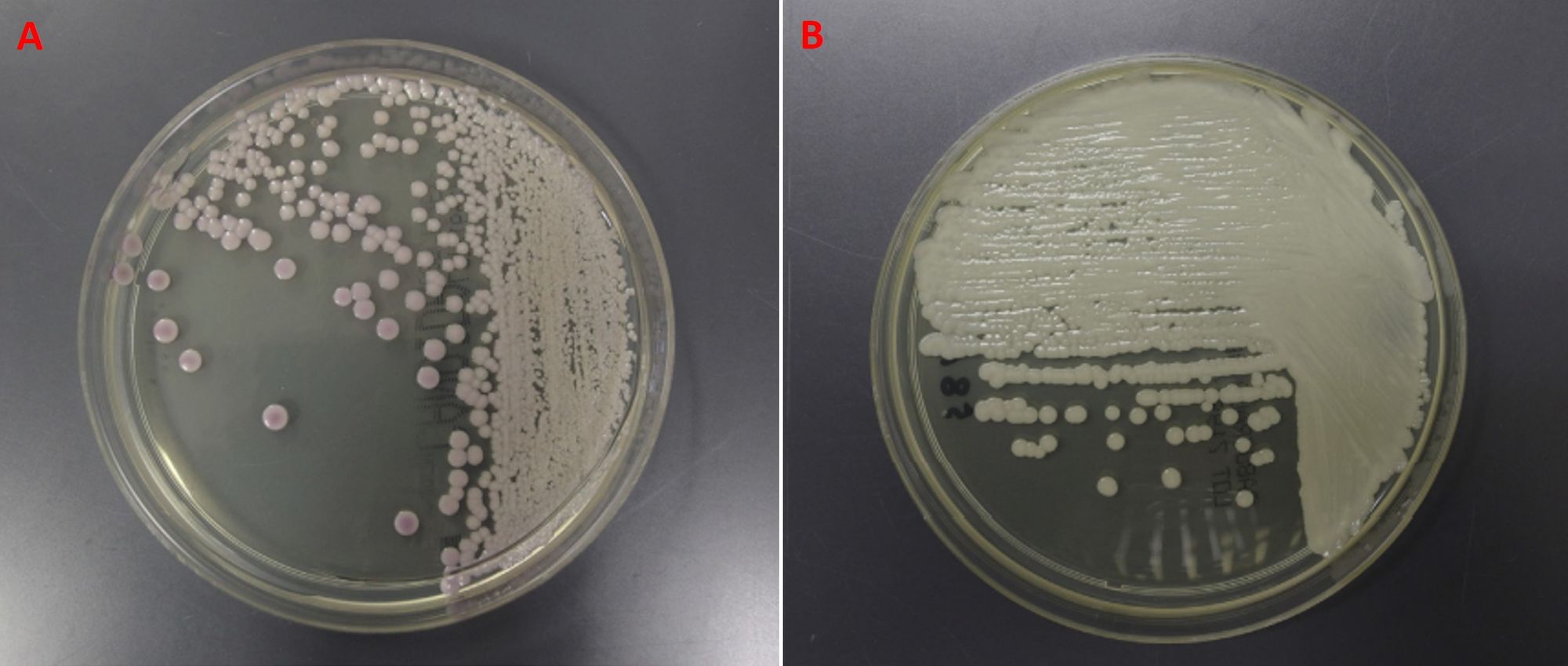
Questo fungo è stato trovato in varie regioni corporee, tra cui la cute, il tratto urogenitale e il tratto respiratorio; le prime due sono abbastanza consuete, mentre la terza è più accidentale. Al livello morfologico C. auris è distinto da cellule ellissoidali (Fig. 1), e sui terreni di coltura genera delle colonie di colore biancastro o rosa pallido, viscose, lisce e luccicanti (Fig. 2).

Contrariamente alle altre specie di Candida, come C. albicans (la più nota), che di solito sono microrganismi commensali che in rare situazioni provocano gravi malattie, C. auris raffigura un pericolo per la salute globale, ed è considerata l’incubo sia del personale medico-sanitario che dei pazienti. Il motivo risiede in molteplici caratteristiche, ovvero l’elevata infettività, la multifarmaco-resistenza, la difficoltà nell’identificazione, l’alta letalità dell’infezione invasiva, la capacità di persistenza negli individui per lunghi periodi, e l’abilità di creare un biofilm (strato muco-polisaccaridico prodotto da batteri e funghi per ricoprirsi e aderire alle superfici) che lo rende poco sensibile ai disinfettanti. Non a caso è stato denominato fungo killer o superfungo. In più, l’Organizzazione Mondiale della Sanità lo ha inserito nella categoria dei “funghi patogeni a priorità critica”.
Nel 2013 il fungo è comparso in America, mentre in Europa i primi focolai risalgono al 2015 in Francia, e da quel momento ci fu un rapido incremento delle segnalazioni; tra gennaio 2013 e dicembre 2017 dichiarati 620 casi, mentre quelli tra gennaio 2018 e dicembre 2019 furono 349. Nel 2018 l’espansione del micete aveva raggiunto il mondo intero, e vennero annunciati episodi in molteplici paesi, tra cui Corea del Sud, India, Pakistan, Bangladesh, Israele, Kuwait, Oman, Malesia, Cina, Emirati Arabi, Arabia Saudita, Iran, Singapore, Thailandia, Sudafrica, Kenya e Spagna. Nel 2019, in Italia, si verificò il primo caso di infezione invasiva, seguito da un focolaio che coinvolse le regioni settentrionali tra il 2020 e il 2021, periodo della pandemia da Covid-19. A tal proposito, svariati studi scientifici mettono in guardia sulla ripetitività di coinfezioni di Sars-CoV-2 e C. auris in diversi paesi. Anzi, bisogna sottolineare che la pandemia ha contribuito ad incrementare i contagi in maniera sconvolgente, e ciò è legato all’abbassamento delle misure per il controllo delle infezioni, dal momento che si riteneva più importante proteggersi dal virus piuttosto che dal micete. Oltre a ciò, gli individui gravemente malati di Covid-19, che necessitano di ventilazione meccanica e rimangono a lungo nei reparti di terapia intensiva, sono più suscettibili all’invasione da parte di C. auris. In una recente intervista Matteo Bassetti, direttore della clinica malattie Infettive del policlinico San Donato di Genova, raccontò che in quell’ospedale il 60% dei 157 pazienti con C. auris era positivo al Sars-CoV-2.
Filogenesi
Dominio Eukaryota
Regno Fungi
Phylum Ascomycota
Subphylum Saccharomycotina
Classe Saccharomycetes
Ordine Saccharomycetales
Famiglia Debaryomycetaceae
Genere Candida
Specie C. auris
Patogenesi e trasmissione
La malattia indotta dai funghi del genere Candida prende il nome di candidosi, che può essere localizzata o diffusa; quella provocata da C. auris si differenzia dalle altre per tre proprietà primarie, di cui abbiamo già accennato precedentemente, ovvero il tasso di mortalità elevato, la virulenza inusuale e la resistenza ai comuni antifungini (come il fluconazolo, l’itraconazolo, il voriconazolo e l’amfotericina B). Quest’ultima è connessa alla presenza di mutazioni nel gene ERG11, il quale gioca un ruolo cruciale nella sensibilità agli antifungini azolici dei miceti di altre specie di Candida.
Le persone che hanno una maggiore probabilità di contrarre infezioni da questo micete sono quelle ricoverate in ospedale o che vivono nelle case di cura (questi raffigurano i luoghi in cui la diffusione è facilitata), quelle a cui sono stati applicati cateteri vescicali, cateteri venosi centrali o tubi da tracheotomia, quelle con un sistema immunitario indebolito (HIV positive, oncologiche) e quelle con problemi di salute preesistenti (diabete mellito). Poiché il lievito permane per settimane sulle superfici, la trasmissione può avvenire non solo in seguito a contatto tra persone, bensì anche in caso di contatto con superfici, oggetti e dispositivi medici contaminati.
L’infezione da C. auris comporta un quadro clinico dissimile in base al sito colonizzato, e le principali patologie sono le infezioni del torrente ematico, le infezioni intra-addominali, le infezioni delle ferite e le otiti. Le manifestazioni cliniche sono alquanto aspecifiche e includono bruciore, febbre, affaticamento, dolori muscolari, difficoltà nella deglutizione; può succedere che il microorganismo invada alcune aree del corpo senza dare alcun sintomo. In aggiunta a ciò, il lievito può arrivare a colonizzare l’intero organismo, inducendo una candidosi sistemica che ricorda la sepsi batterica, con conseguente danno agli organi vitali ed esito fatale in assenza di un trattamento. Tuttavia, anche con una terapia efficace, nel 30-40% dei casi si va incontro a decesso.
Citiamo ora un caso pubblicato sul New York Times, nel 2019, a proposito di un uomo anziano ricoverato presso la succursale di Brooklyn del Mount Sinai Hospital, dal momento che doveva subire un intervento di chirurgia addominale. L’emocoltura rivelò la presenza di un microorganismo scoperto da poco, tanto letale quanto misterioso. I medici isolarono rapidamente il paziente nell’unità di terapia intensiva, e l’uomo morì nel giro di novanta giorni. In seguito al decesso, la stanza venne sottoposta a campionamento ambientale, e le analisi evidenziarono una contaminazione da parte dello stesso micete sui muri, sul materasso, sulle ringhiere del letto, sulle porte, sulle tende, sui telefoni, sul lavandino, sulle lavagne e sulle aste della flebo. Tale situazione obbligò, oltre alle pulizie, anche alla sostituzione di una parte del controsoffitto e delle piastrelle del pavimento.
Identificazione
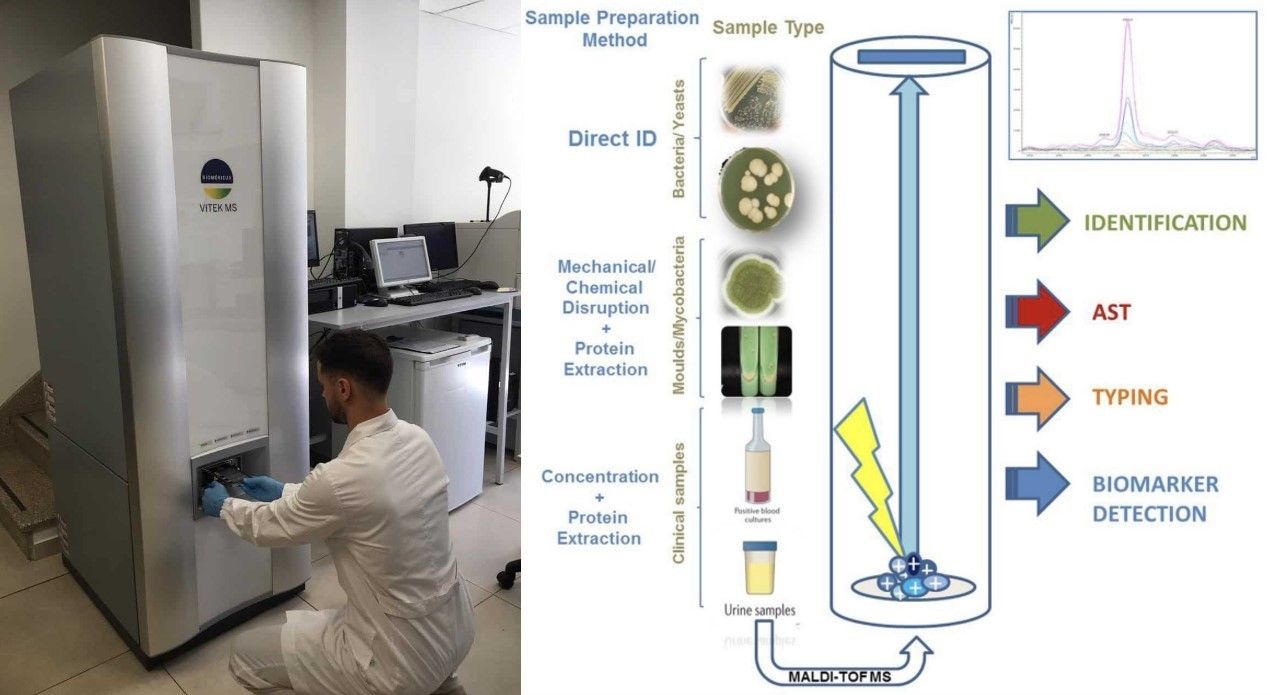
Generalmente le infezioni da funghi del genere Candida prevedono una procedura diagnostica basata su esame colturale di campioni di sangue o di altri fluidi corporei. Il problema di C. auris è l’alta probabilità di essere confusa con altre specie, per esempio C. haemulonii, e per tale ragione è opportuno l’impiego di strumenti diagnostici più sofisticati e dotati di una maggiore sensibilità e specificità; un esempio è la spettrometria di massa con MALDI-TOF (Matrix Assisted Desorption Ionization - Time Of Flight) (Fig. 3), che consente di discernere le varie specie di Candida, anche se non è detto che il database di riferimento degli spettrometri MALDI-TOF, utilizzato da un determinato laboratorio, includa C. auris. Nel momento in cui si nota un ceppo di Candida resistente a diversi farmaci, è possibile che ci si trovi di fronte a un caso di C. auris, però è importante avere la conferma da parte di un laboratorio di riferimento. Comunque, quando si isola C. auris, bisogna sempre eseguire i test di suscettibilità antimicotica, al fine di evitare di dare ai pazienti farmaci tollerati dal fungo.
A Londra, quando si verificò un’epidemia presso il Royal Brompton Hospital, nel 2015/2016, venne effettuato uno screening dei pazienti e del personale mediante la raccolta di multiple tipologie di campioni (urine, feci, sangue, tamponi nasali, faringei, ascellari, inguinali, rettali, di mani, da ferita), che furono inoculati su agar Sabouraud, e identificati come isolati di Candida grazie alla semina su Chromogenic agar. Gli isolati non appartenenti a C. albicans furono associati a determinate specie grazie all’analisi con MALDI-TOF. Oltre a ciò, il personale di laboratorio eseguì il test di suscettibilità antimicotica mediante diluizione dei farmaci in un brodo di coltura. I risultati dello screening riportarono un numero di 50 casi, di cui 9 candidemie.
Sotto la guida della dottoressa Johanna Rhodes, esperta di malattie infettive all’Imperial College di Londra, il personale ospedaliero impiegò un dispositivo speciale per spruzzare perossido d’idrogeno, sotto forma di aerosol, nella stanza di un paziente risultato positivo al micete. Lasciarono agire il dispositivo per una settimana e misero al centro della stanza una piastra di coltura per evidenziare eventuali microorganismi sopravvissuti. Su questa piastra crebbe soltanto C. auris.
Terapia e profilassi
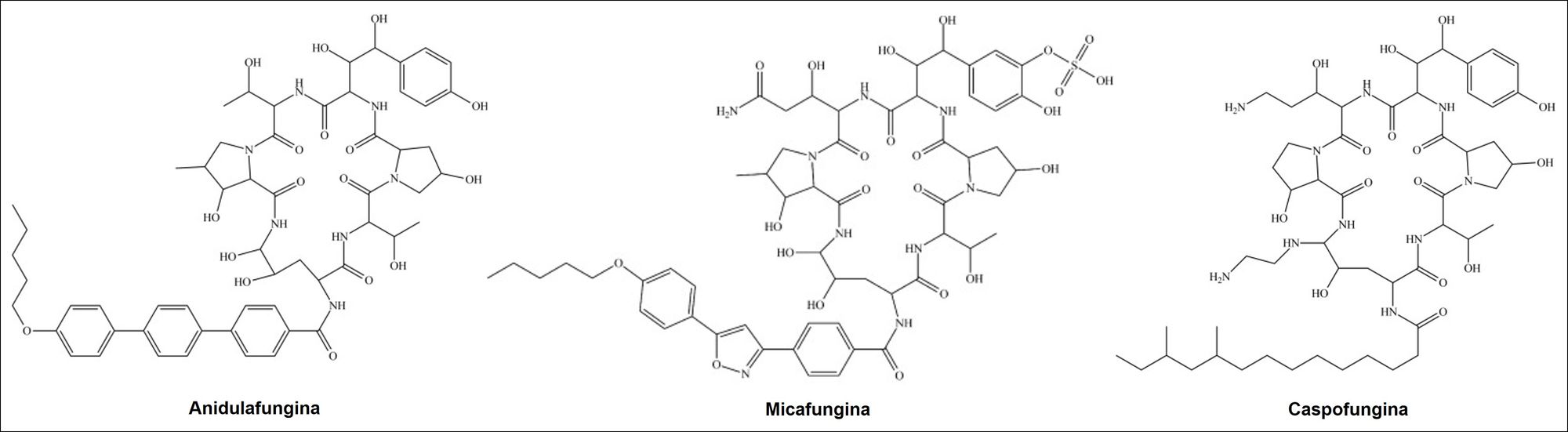
In genere quando ci si trova di fronte a una candidiasi invasiva da C. auris, i farmaci a cui si ricorre sono le echinocandine, come la caspofungina, la micanfungina e l’anidulafungina (Fig. 4), che vengono usate anche in caso di aspergillosi invasiva. Questi antifungini sono dei lipopeptidi semisintetici che si ottengono mediante la fermentazione cellulare di vari miceti (Aspergillus rugulovalvus, Zalerion arboricola e Papularia sphaerosperma), e agiscono inibendo l’enzima 1,3-beta-D-glucano-sintasi, essenziale per la formazione del 1,3-beta-D-glucano, un componente delle pareti delle cellule fungine. Di conseguenza, le cellule vanno incontro a lisi. Tuttavia, può capitare di avere a che fare con infezioni da C. auris resistenti anche alle echinocandine, oltre che agli azoli e all’amfotericina B. Tale inconveniente rende necessario un trattamento con più farmaci e a dosi massive.
Spesso il fungo permane sui pazienti per periodi prolungati anche una volta terminata la terapia, in siti dove non causa la malattia (come la cute). Ciononostante, è in grado di diffondersi, quindi è opportuno mettere in atto le varie misure di controllo sia durante che dopo il trattamento.
Per quanto concerne la prevenzione e il contenimento della diffusione di C. auris, elenchiamo le varie procedure fondamentali:
- Se all’interno di una struttura clinica si scopre che uno o più persone sono colonizzate, collocarle in stanze singole, e mantenere una distanza di almeno un metro tra individui malati e individui sani;
- Ogni volta che ci si occupa di pazienti affetti, indossare dispositivi di protezione individuale, come guanti, camice e mascherina. Questi devono essere poi rimossi quando si esce dalla stanza dove si trova quel paziente;
- Prima e dopo il contatto con persone infette o con i loro oggetti personali, lavare le mani con acqua e sapone, oppure applicare un disinfettante alcolico. Il lavaggio accurato e frequente delle mani deve essere fatto anche dagli individui colonizzati o infettati;
- Pulire e disinfettare le apparecchiature condivise tra i pazienti, e le superfici ambientali usando soluzioni a base di cloro o candeggina al 10%, che bisogna lasciare agire per dieci minuti;
- La manipolazione e il trasporto della biancheria devono essere fatti evitando qualsiasi contatto con le superfici;
- Se ci sono dei nuovi casi, effettuare lo screening tramite tamponi inguinali e ascellari;
- Riferire lo status di colonizzazione o infezione di un paziente nel caso in cui questi debba essere trasferito in un’altra struttura.
Lorenzo Tramontana
Fonti
- Kazuo Satoh, Koichi Makimura, Yayoi Hasumi, Yayoi Nishiyama, Katsuhisa Uchida, Hideyo Yamaguchi. 2009. “Candida auris sp. nov., a novel ascomycetous yeast isolated from the external ear canal of an inpatient in a Japanese hospital”, Microbiology and Immunology
- S. Iguchi, Y. Itakura, A. Yoshida, K. Kamada, R. Mizushima, Y. Arai, Y. Uzawa, K. Kikuchi. 2019. “Candida auris: A pathogen difficult to identify, treat, and eradicate and its characteristics in Japanese strains”, Journal of Infection and Chemotherapy
- Shawn R. Lockhart, Kizee A. Etienne, Snigdha Vallabhaneni, Joveria Farooqi, Anuradha Chowdhary, Nelesh P. Govender, Arnaldo Lopes Colombo, Belinda Calvo, Christina A. Cuomo, Christopher A. Desjardins, Elizabeth L. Berkow, Mariana Castanheira, Rindidzani E. Magobo, Kauser Jabeen, Rana J. Asghar, Jacques F. Meis, Brendan Jackson, Tom Chiller, Anastasia P. Litvintseva. 2016. “Simultaneous Emergence of Multidrug-Resistant Candida auris on 3 Continents Confirmed by Whole-Genome Sequencing and Epidemiological Analyses”, Clinical Infectious Diseases
- Silke Schelenz, Ferry Hagen, Johanna L. Rhodes, Alireza Abdolrasouli, Anuradha Chowdhary, Anne Hall, Lisa Rya, Joanne Shackleton, Richard Trimlett, Jacques F. Meis, Darius Armstrong-James and Matthew C. Fisher. 2016. “First hospital outbreak of the globally emerging Candida auris in a European hospital”, Antimicrobial Resistance & Infection Control
- https://www.epicentro.iss.it/candida-auris/
- https://www.salute.gov.it/portale/malattieInfettive/dettaglioSchedeMalattieInfettive.jsp?lingua=italiano&id=249&area=Malattie%20infettive&menu=indiceAZ&tab=1
- https://www.today.it/scienze/bassetti-italia-candida-auris.html
- https://www.today.it/salute/candida-auris-fungo-killer-espansione.html
- https://www.cdc.gov/fungal/candida-auris/patients-qa.html
- https://www.nurse24.it/studenti/standard/raccomandazioni-controllo-infezione-candida-auris.html
- https://www.fnob.it/2023/03/28/allarme-candida-auris-il-fungo-che-minaccia-gli-stati-uniti/
- https://www.rainews.it/articoli/2022/07/candida-auris-cos-e-quali-sono-i-sintomi-del-fungo-che-ha-contagiato-e-ucciso-un-70enne-a-mestre-b60c2fcf-1cd2-44d2-a389-48494fc16b95.html
- https://www.nytimes.com/2019/04/06/health/drug-resistant-candida-auris.html
- https://www.altroconsumo.it/salute/dal-medico/news/candida-auris
- https://www.sciencedirect.com/topics/chemistry/echinocandin
- https://www.cibic.com.ar/laboratorios-bioquimicos/incorporacion-tecnologia-maldi-tof-ms-la-rapida-identificacion-microbiana/
- Marina Oviano and Belén Rodríguez-Sánchez. 2020. “MALDI-TOF mass spectrometry in the 21st century clinical microbiology laboratory”, Enfermedades Infecciosas y Microbiología Clínica
Ti è piaciuto l'articolo?
 BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
BioDaily.it non riceve alcun contributo pubblico né ospita alcuna pubblicità, quindi si sostiene esclusivamente grazie alle donazioni dei lettori. Ti ringraziamo qualora tu volessi fare una donazione al nostro progetto, puoi farlo cliccando su questo messaggio.
